Клінічна ефективність застосування ангіопротекторів в комплексному лікуванні загрози передчасних пологів, обтяжених антифосфоліпідним синдромом
����: 2009/2/20 | ������: Здоровье женщины
Т.Т. Наритник, В.Н. Кущ
Національний медичний університет ім. О.О. Богомольця, м. Київ
Вступ
На сьогоднішній день невиношування вагітності є однією з основних проблем охорони здоров'я в економічно розвинених країнах. Її медичне значення зумовлене високою частотою поширеності цього ускладнення, що складає 10 25% від загальної кількості вагітностей [4, 19]. Зростаючі можливості оцінки внутрішньоутробного стану і розвитку плода, розробка нових методів дитячої реанімації і виходжування недоношених дітей призвели до того, що поняття «невиношування вагітності» та «передчасні пологи» за своїм змістом з часом змінилися. Так, згідно з номенклатурою ВООЗ, а з 01.01.2007 року і в Україні переривання вагітності з 22 до 28 тижнів відносять до ранніх передчасних пологів, і в більшості країн саме з цього строку гестації розраховують перинатальну смертність.
Серед величезної кількості причин невиношування вагітності аутоіммунні фактори, на думку вітчизняних і зарубіжних дослідників, відіграють одну з провідних ролей [ 2, 6, 7, 20, 21] . Особливу значимість ці питання, на наш погляд, мають в строки 22–28 тижнів вагітності, коли компенсаторні можливості прогностично життєздатного плода мають крихкий і недосконалий потенціал, а ризик перинатальних втрат особливо великий.
Антифосфоліпідний синдром (АФС), в основі якого лежить розвиток аутоімунної реакції до фосфоліпідних (ФЛ) детермінант, присутніх на мембранах тромбоцитів, клітинах ендотелія судин та нервової тканини, був описаний на початку 80-х років минулого століття у зв'язку з інфікуванням системною червоною вовчанкою (СЧВ). На сьогоднішній день АФС представляє загальномедичну мультидисциплінарну проблему, яка, не дивлячись на пильний інтерес дослідників, далека від кардинального вирішення.
На даний час під поняттям «антифосфоліпідний синдром» розуміють симптомокомплекс, що поєднує клінічні ознаки і лабораторні дані, а саме: наявність антифосфоліпідних антитіл (АФА) в поєднанні з венозними і артеріальними тромбозами, синдромом втрати плода, імунною тромбоцитопенією і/або неврологічними розладами. Термін АФС прийнятий при поєднанні лабораторних ознак циркуляції АФА і одного або більше клінічних проявів. Критерії діагностики синдрому були сформульовані в 1999 році на VIII Міжнародному симпозіумі із вивчення ролі антитіл до фосфоліпідів (Саппоро, Японія; Wilson W.A. і співавт., 1999).
Мета дослідження — комплексна оцінка ступеня і взаємозв'язку аутоімунних і гемостазіологічних порушень у вагітних із загрозою ранніх передчасних пологів і визначення можливих шляхів корекції таких станів.
Матеріал і методи дослідження
Відповідно до поставленої мети і завдання наукової роботи був проведений люпус&тест серед 85 вагітних з невиношуванням вагітності нез'ясованого генезу («Технологія-стандарт», Росія) на наявність вовчанкового антикоагулянту (ВА) — специфічного маркера АФС — в строках гестації 22–28 тижнів за методиками З.С. Баркаган і співавторів (1995). У 48 жінок (56,5%) отримано позитивний тест на ВА і встановлено діагноз АФС. Контрольну групу склали 30 здорових вагітних жінок у відповідних строках вагітності та за відсутності АФА в крові.
Скринінгові методи здійснювалися за допомогою таких фосфоліпід&залежних тестів: АЧТЧ з низьким вмістом фосфоліпідів (PTT&LA, Stago, Франція) і час розведеної отрути гадюки з розведеним тромбопластином (TTL, Stago, Франція). Якщо фосфоліпід&залежні тести були нормальні, то скринінгова проба на ВА вважалася негативною. Необхідність здійснення додаткових фосфоліпід&залежних тестів (одного або декількох) обумовлювалося корегуючою пробою шляхом змішування досліджуваної плазми з нормальною плазмою в співвідношенні 1:1, 1:4, 4:1 для виключення дефіциту фактора згортання. Якщо при додаванні нормальної плазми фосфоліпід&залежні тести залишалися подовженими, проводилися тести, підтверджуючі спрямованість циркулюючих інгібіторів проти фосфоліпідів. Для цієї мети використовувалися лізати тромбоцитів (PNP Stago, Франція) і гексагональний фосфоліпід (Stadot, Stago, Франція). Скорочення АЧТЧ свідчило про антифосфоліпідну природу циркулюючих інгібіторів. Згодом у всіх вагітних жінок з позитивними результатами люпус-тесту був проведений ЕЛІ-АІМ-тест [8], що заснований на імуно-ферментному аналізі і призначений для порівняльного напівкількісного визначення аутоантитіл до найбільш специфічних маркерів антифосфоліпідного синдрому (до â2-глікопротеїну і IgG-антитіл до â2-глікопротеїну). Визначення IgМ- і IgG-аутоантитіл до мембранних ФЛ про водилося методами ІФА із використанням препаратів 4ФЛ, виділених з тваринної сировини методами розподільчої хроматографії: фосфатиділсерин (ФС) з мозку бика, фосфатиділетаноламін (ФЕ) і фосфатиділхолін (ФХ) з курячого жовтка, кардіоліпін (КЛ) із серця бика (Науковий центр перинатології, акушерства і гінекології РАМН, Москва). Вимірювали оптичну густину (ОГ) при 492 нм на фотометрі «Multiscan MCC/340» (Labsystems, Фінляндія). Результати аналізу вважали позитивними, якщо середня ОГ досліджуваного зразка перевищувала суму середньої ОГ для негативних контролів і трьох середньоквадратичних відхилень. Точне значення обчислювали за допомогою стандартної кривої, побудованої для визначеної кількості вимірюваного субстрату (лунки з контрольними зразками у відповідних концентраціях).
Загальнооціночні дослідження системи гемостазу, що включали визначення концентрації фібриногену за методом Clauss, активованого часу рекальцифікації (АЧР) у присутності каоліну, активованого часткового тромбопластинового часу (АЧТЧ) у присутності каоліну і фосфоліпіду. Маркери тромбінемії (ТАТ) визначалися за допомогою набору Enzy-nost-TAT (Boehringwerke, Німеччина) імуноферментним способом на спектрофотометрі «Boenrin Elisa-Photometr». Визначення низькомолекулярних продуктів деградації фібрину і фібриногену (ПДФФ) проводилося за допомогою
Латекс-тесту «Behringer Manneheim» (Німеччина), а високо-молекулярних — тесту склеювання стафілококів за Hawigen і співавт. Концентрація AT&III визначалася за допомогою стандартних пластин NOR-Partigen AT-III виробництва фірми «Behrigwerke» (Німеччина) за методом Manchini і співавторів, активність AT&III і протеїну-С — методом хромогенних субстратів за допомогою комерційних наборів фірми «Behrigwerke» (Німеччина) на приладі «Chromotimer». Кількість тромбоцитів в периферичній крові визначали на автоматичному лічильнику «Trombocounter» (Франція).
Вміст інтерлейкіну-3 у венозній крові визначали за допомогою наборів «Procon IL-3» (Beringer Ingelheim, Німеччина). ІЛ-3 представляє собою гліколізований білок з молекулярною вагою 15–28 кДа, що синтезується клітинами Th1 і Th2, а також В-лімфоцитами, мієлоїдними, стромальними клітинами. Цей маркер має регуляторний вплив на фібринолітичні процеси в ендометрії за рахунок активації урокінази, що перетворює плазміноген в плазмін.
Усім жінкам проведені дослідження матеріалів, вилучених із піхви, цервікального каналу шийки матки і сечі на наявність грампозитивних і грамнегативних мікроорганізмів, дріжджеподібних грибів, генітальних мікоплазм (М. hominis, U. urealiticum) та хламідій із використанням культуральних і молекулярно-біологічних методів. Про стан плода робили висновки за даними клінічного обстеження, КТГ, УЗД плода і плаценти, допплерометрії.
Статистичну обробку отриманих результатів дослідження проводили за допомогою стандартного пакету програм «Statistika» з обчисленням і порівнянням середніх величин цифрових даних.
Результати досліджень та їх обговорення
Аналіз клініко&анамнестичних даних показав, що серед перенесених соматичних захворювань у пацієнток з наявністю АФА переважали серцево&судинні захворювання. У 37,5% випадків спостерігалася вегето-судинна дистонія, у 18,75% — вади клапанів серця, у 14,6% — артеріальна гіпертензія. Наступними за частотою були: захворювання органів дихання (21,2%), захворювання сечовивідної системи (20,5%) з супутньою протеїнурією (14,6%). Патологія шлунково&кишкового тракту спостерігалася у кожної третьої вагітної, у 39,6% жінок анамнез був обтяжений вірусами, інфекціями в дитячому віці.
Частота і характер гінекологічних захворювань у обстежених жінок представлені в табл. 1.

При проведенні скринінга на приховану генітальну інфекцію було виявлено, що у вагітних жінок з АФА в 2 рази частіше зустрічалися Chl. trachomatis і U. ureali_ ticum (p<0,01).У ході наукової роботи були проаналізовані результати попередніх вагітностей у пацієнток контрольної і основної груп (табл. 2).

Очевидно, що у 18 (16,7%) випадках попередня вагітність у жінок основної групи була перервана артифіціальним абортом або за типом ектопічної вагітності, причому у 12 випадках саме перша вагітність мала настільки несприятливий результат. Аналіз решти 96 випадків вказує на самовільне переривання вагітності в строках до 22&х тижнів у 34 (29,83%) випадках та ускладнення у вигляді завмерлої вагітності або загибелі плода — у 39 (34,2%). Таким чином, мимовільне переривання вагітності, антенатальна загибель плода відмічалися у кожної третьої жінки основної групи. Звертає на себе увагу висока частота передчасних пологів у обстежених пацієнток — 14 (12,28%), ускладнених подальшою загибеллю плода в 11 (9,65%) випадках. Тільки у 9 повторно вагітних жінок подальша вагітність завершилася терміновими пологами, але і тут, у кожної третьої жінки новонароджений помер через різні причини. Слід відзначити, що переважна кількість жінок основної групи не могла вказати вірогідної причини несприятливого результату попередніх вагітностей і пологів. Без сумніву, поєднання різноманітних факторів ризику, виявлених у вагітних основної групи, не могло не вплинути на перебіг даної вагітності.
Окрім загрози ранніх передчасних пологів, також були відмічені інші, не менш значимі гестаційні ускладнення (табл. 3).
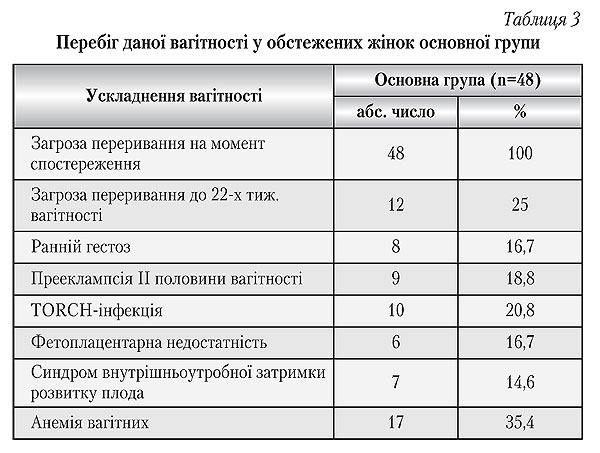
Отримані дані свідчать, що перебіг вагітності у обстежених жінок основної групи з наявністю АФА в крові має свої особливості.
Так, загроза переривання вагітності на момент обстеження у кожної четвертої жінки носила рецидивуючий характер. Найчастішими ускладненнями даної вагітності були анемія вагітних — 17 (35,4%) випадків і TORCH-інфекція — 10 (28%). Звертає увагу несприятлива тенденція погіршення перебігу вагітності пропорційно строку гестації. Так, якщо на ранніх строках вагітність була ускладнена раннім гестозом у 8 (16,7%) пацієнток, то в більш пізніх строках вже 9 (18,8%) вагітних жінок основної групи страждали прееклампсією, яка погано піддавалася лікуванню на тлі фетоплацентарної недостатності і синдрому внутрішньоутробної затримки розвитку плода — 8 (16,7%) і 7 (14,6%) епізодів відповідно.
Аналіз отриманих клініко&лабораторних даних свідчить про значну частоту розвитку гемостазіологічних порушень у жінок із загрозою передчасного переривання вагітності. Найчастішими їх проявами були помірна тромбоцитопенія — 21 (45,7%) випадок, яка не супроводжувалася ознаками підвищеної кровоточивості, а також ангіопатія сітківки у кожної четвертої вагітної (12 випадків). Остання у більшості хворих була виявлена вперше, проявлялася в незначних змінах артерій очного дна і не супроводжувалася порушенням зору. Ці клінічні дані підтверджуються лабораторними показниками (табл. 4).
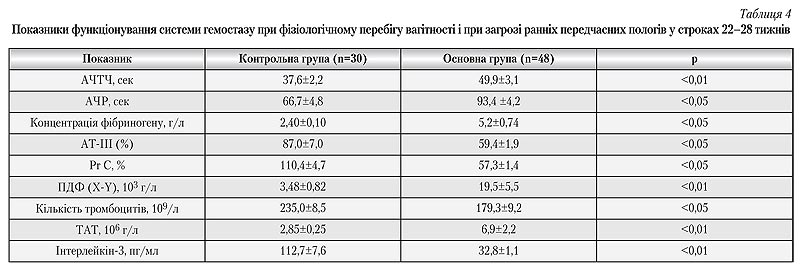
Отже, у венозній крові вагітних жінок із загрозою ранніх передчасних пологів відбувається подовження активованого часткового тромбопластинового часу (АЧТЧ) і активованого часу рекальцифікації (АЧР), що свідчить про явища гіперкоагуляції в судинному руслі вагітної жінки. Вказані зміни прогресують із зростанням титру АФА, особливо до â2&глікопротеїну (âГП1), фрагментів імуноглобулінів (FC) і денатурованої ДНК. Також на тлітенденції до гіперфібриногенемії спостерігається підвищення концентрації ПДФ, що вказує на активацію факторів внутрішньосудинного згортання. На користь цього свідчить і статистично підтверджена тромбоцитопенія, виявлена у більш ніж 75% обстежених пацієнток. Характерно, що при первинному обстеженні цей показник був єдиним аномальним серед інших лабораторних параметрів загальноклінічного дослідження.
Несприятливим прогностичним фактором виявилася тенденція до зниження концентрації антитромбіна III (АТ&III) з 87,0±7,0 до 59,4±1,9, що у поєднанні із зростанням специфічних факторів тромбінемії (ТАТ) можна розцінювати як чинники, що загрожують виникненням тромботичних ускладнень. Ці дані узгоджуються з результатами, отриманими іншими дослідниками [10, 13].
Проведені дослідження свідчать про прогресування АФС у вагітних жінок із загрозою ранніх передчасних пологів. Це проявляється у зростанні титрів специфічних АФА (áâГП1, áFC, áДНК), а також аномально низьких титрів сумарних фосфоліпідів, що може розцінюватися як явище тотальної поліклональної імуносупресії, істотно ускладнюючої імунологічну толерантність матері до плода [9, 15]. На тлі виявлених порушень відмічалося зниження природного антикоагулянта — протеїну-С (PRC) — з підвищенням резистентності до активованого протеїну-С, що низкою науковців розцінюється як тромботично небезпечний стан [3]. Характерно, що у 78,2% пацієнток основної групи стан резистентності до активованого протеїну-С було виявлено за відсутності мутації фактора V. Leiden, що свідчило про порушення функціонування природної антикоагулянтної системи в умовах циркуляції АФА. Одночасно спостерігалося виражене (триразове) статистично підтверджене (р<0,01) зниження концентрації інтерлейкіну-3, що свідчило про значне пригнічення ендогенних фібринолітичних процесів. Таким чином, у вагітних жінок із загрозою передчасних пологів та явищами АФС відмічалися значні порушення в системі гемостазу, що проявлялися у вигляді аномальної гіперкоагуляції, невластивої строку вагітності, тромбоцитопенії, зниженні активності природних антикоагулянтів, активації внутрішньосудинного згортання.
З метою корекції виявлених порушень пацієнтки основної групи були розділені на 2 підгрупи: I — 26 вагітних, які отримували традиційне лікування, спрямоване на попередження передчасних пологів (гініпрал, актовегін, курантіл, рибоксин, реосорбілакт, ессенціале, магнезіальна терапія), ІІ — 22 пацієнтки, у схему лікування яких, поряд із традиційною терапією, були включені препарати з вираженими венопротекторними і лімфо тонізуючими властивостями (солкосерил і детралекс).
Аналіз отриманих даних свідчить, що традиційна терапія, спрямована на купірування явищ загрози переривання вагітності, що включала гормональні, токолітичні, седативні препарати, інфузійну терапію, не усуває в належній мірі виявлені порушення імунного і гемостатичного гемостазу. В крові вагітних жінок І підгрупи, незважаючи на проведену терапію, зберігалися явища аутоімунної агресії. Незначна позитивна динаміка показників сумарних антифосфоліпідів не призводила до стабілізації антикардіоліпінових маркерів та рівнів аутоантитіл до кофакторів фосфоліпідів, а також до фрагментів імуноглобулінів і ДНК, що підтверджувалося зниженими параметрами гуморального імунітету і пригніченням імуносупресивних процесів.
Вищезазначені явища негативно впливали на параметри гемостазу у обстежених жінок. Це підтверджувалось аномальною внутрішньосудинною коагуляцією у вигляді накопичення ПДФФ і ТАТ&маркерів, пригнічення антикоагулянтної і фібринолітичної ланок, збереженою тромбоцитопенією і агрегацією тромбоцитів. Слід зазначити, що незначна стабілізація параметрів гемостатичного потенціалу відмічалася лише при низькому або помірному ступені вираженості АФС (7 випадків із 14), але була відсутня при високих показниках аутоімунних комплексів (12 спостережень).
У 6 пацієнток І підгрупи вагітність ускладнилась повторними явищами загрожуючого переривання вагітності, у 2 — прееклампсією, у 1 — клінікою фетоплацентарної недостатності, у 1 — синдромом внутрішньоутробної затримки розвитку плод. У 2 випадках вагітність в терміні 27 тижнів ускладнилась передчасним відшаруванням нормально розташованої плаценти з наступним кесаревим розтином за життєвими показаннями, із них в одному випадку дитина із масою тіла при народженні 920 г померла на 4&ту добу життя, в другому — новонароджений масою 970 г на 8-му добу був переведений для подальшого виходжування у спеціалізованому відділенні. Таким чином, традиційна терапія, що застосовувалася у І підгрупі, виявилась малоефективною у 12 із 26 випадків.
Включення в комплексну терапію жінок із загрозою передчасних пологів та явищами АФС препаратів солкосерилу і детралексу була зумовлена багатьма міркуваннями.
Солкосерил є безбілковим гемодіалізатом і ультрафільтратом крові молочних телят з широким спектром природних низькомолекулярних неорганічних і органічних компонентів (номінальний розмір молекул — 5000 D). Препарат містить низькомолекулярні пектиди, деривати нуклеїнових кислот і амінокислот, гліколіпіди; 1 мл солкосерилу містить 42,5 мг сухої речовини, хімічно і біологічно стандартизованої розчинної у воді для ін'єкцій. Завдяки своїй структурі, а також наявності комплексу мікро- і макроелементів (селен, калій, залізо, мідь та ін.), препарат володіє універсальним мембрано- і цитопротекторним ефектами, чинить ендотеліотропну, антигіпоксичну та ангіопротекторну дію, сприяє продукції ендотеліальних факторів релаксації (Громико Г.Л., 2000; Аржанова О.Н. і співавт., 2002; Gibils L.A., 2001; Scordino M. і співавт., 2003). Позитивний клінічний ефект при невиношуванні вагітності, лікуванні плацентарної недостатності та перинатальної гіпоксії новонароджених відмічений рядом авторів (Кошелева Н.Г., Плужникова Т.А., 1998; Сідєльникова В.М., 2000; Шамсієв Ф.С. і співавт., 2001; Руденко А.Ю. і співавт., 2003; Маркін Л.В., Флуд В.В., 2006).
Детралекс (мікронізована очищена фракція флавоноїдів 500 мг) — флеботропний препарат з комплексною венопротекторною і лімфотонізуючою дією. За своїм хімічним складом він відноситься до D-бензпиренів, які, в свою чергу, є представниками великої групи біологічно активних речовин — біофлавоноїдів. Важливою особливістю детралексу, яка відрізняє його від інших веноактивних біофлавоноїдів, є мікронізація — спеціальна технологічна обробка, що значно зменшує частки препарату і забезпечує високу швидкість всмоктування в травному тракті. За рахунок цього терапевтична концентрація детралексу в крові визначається вже через 4 години після прийому. Окрім ангіо- і мембранопротекторної дії, відмічено імуномодулюючий ефект препарату, здатність покращувати гемомікроциркуляторний гемостаз за рахунок зниження агрегації тромбоцитів (Макаров О.В., Озолиня Л.А., 2000; Сенчук А.Я., Венцківський Б.М., 2003; Manning F. і співавт., 2002; Dubiel M. і співавт., 2004). Деякі вітчизняні науковці відмічають ефективність детралексу при лікуванні плацентарної недостатності, варикозної хвороби вен нижніх кінцівок у вагітних, корекції гемодинамічних порушень при ускладненому перебігу гестаційного процесу (Маркін Л.Г. і співавт., 2004; Лук'янов І.С. і співавт., 2005; Паращук Ю.С. і співавт., 2005; Пирогов В.І., Охабська І.І., 2006). Слід відмітити, що обидва препарати не проникають через гематоплацентарний бар'єр, добре переносяться пацієнтками, під час їх застосування жодного епізоду алергічних ускладнень відмічено не було.
Отримані результати вказували на позитивну динаміку імунологічних показників у пацієнток ІІ підгрупи після проведеного лікування. Стійка стабілізація показників сумарних áФЛА супроводжувалася зниженням титрів аутоантитіл до КЛ і â2&ГП1, а також до ДНК і FC, що свідчило про позитивний імунокорегуючий ефект і активацію супресорних можливостей материнського організму. Зниження ступеня тяжкості аутоімунних відхилень супроводжувалася зменшенням внутрішньосудинної коагуляції, агрегації тромбоцитів і активацією параметрів антикоагулянтної ланки. Відновлення балансу між основними індикаторами тромбоцитарної, прокоагулянтної й антикоагулянтної ланок системи гемостазу проявлялося у вигляді стабілізації загальноклічіних показників АЧТЧ і АЧР.
Необхідно відмітити, що включення ангіопротекторів в комплексну терапію жінок із загрозою недоношування вагітності супроводжувалося позитивним впливом на гемодинамічні процеси у фетоплацентарному комплексі.
Клінічні спостереження свідчили про позитивний вплив рекомендованої терапії на перебіг вагітності у пацієнток ІІ підгрупи. Так, лише у 2 вагітних із 22 в подальшому були відмічені гестаційні ускладнення, із них в 1 випадку була загроза передчасних пологів в терміні 31–32 тижні вагітності, а в 1 — прееклампсія легкого ступеня в терміні 35–36 тижнів. Супутній функціональний моніторинг, включаючи ультразвукове дослідження, плацентографію, також вказував на позитивну динаміку показників фетоплацентарного комплексу у порівнянні з жінками І підгрупи.
В цілому, в результаті проведеного лікування вагітність вдалося зберегти у 46 жінок основної групи. Відмічалося зменшення тривалості перебування в стаціонарі вагітних жінок, які отримували солкосерил і детралекс з 14,6 до 9,7 днів. У 2 пацієнток, які були зараховані до І підгрупи, не дивлячись на тимчасовий ефект від проведеної терапії, в терміні 27 тижнів гестації відбулося передчасне відшарування нормально розташованої плаценти.
Аналіз результатів вагітності і пологів свідчить, що у 14 жінок І підгрупи вагітність завершилася терміновими фізіологічними пологами живих доношених дітей. У 3 випадках пологи завершились операцією кесарського розтину (клінічно вузький таз, обтяжений акушерським і соматичним анамнезом); 6 пологів були передчасними, із них на 27-му тижні народило 2 жінки, на 32–33-му — 2, на 34-му — 2 (4 дитини померли, 2 були живими). Слід відмітити, що у 5 пацієнток пологи ускладнилися явищами внутрішньоутробної гіпоксії плода.
У 19 жінок ІІ підгрупи вагітність закінчилася терміновими фізіологічними пологами, у 1 — кесаревим розтином (вік пацієнтки — 32 роки, тазове передлежання, слабкість пологової діяльності). Середня маса недоношених новонароджених становила 1230±50 г, доношених — 3200±300 г. Порівняльна оцінка крововтрати в пологах свідчить про більш високі показники у І підгрупі (920,0±45,0), ніж у ІІ (450,0±27,0). Результати вагітності у 5 жінок прослідкувати не вдалося, оскільки вони були госпіталізовані до початку пологів в інші акушерські стаціонари.
Аналізуючи отримані результати, необхідно відзначити важливу роль аутоімунних порушень і гемостазіологічного
дисбалансу в патогенезі загрожуючих ранніх передчасних пологів. Аномальна гіперпродукція аутоантитіл до фосфоліпідів, їх кофакторів та індикаторів нуклеотидного обміну веде до наростання аутоімунної агресії і патологічної активації гемостазу у вигляді дисемінованої внутрішньосудинної коагуляції, пригнічення антикоагулянтної і фібринолітичної ланок гемостазу, що створює передумови для реалізації загрожуючих тромбофілічних ускладнень. Комплексне дослідження маркерів імунологічного статусу і гемостатичного потенціалу в материнській венозній крові при загрозі ранніх передчасних пологів має високу діагностичну цінність і дозволяє прогнозувати тромбогеморагічні
порушення на ранніх етапах їх розвитку. Включення в комплексну терапію недоношування вагітності ангіопротекторів (солкосерилу і детралексу) забезпечує усунення гемостазіологічних порушень і зниження ступеня тяжкості АФС, потенціює дію загальноприйнятих методів лікування і сприяє подальшому пролонгуванню вагітності.
Висновки
1. Враховуючи ускладнений перебіг вагітності у жінок із АФС, надзвичайно важливим є своєчасне обстеження даного контингенту хворих до настання вагітності, діагностика і корекція гемостазіологічних та імунних порушень, динамічний контроль за перебігом вагітності.
2. При загрозі передчасних пологів у жінок із АФС доцільним є включення у комплексну терапію ангіопротекторів солкосерилу і детралексу з метою запобігання небажаних ускладнень.
3. Застосування солкосерилу і детралексу сприяє позитивному клінічному перебігу вагітності, запобігає розвитку геморагічних ускладнень, знижує показники перинатальної захворюваності і смертності серед новонароджених.
ЛІТЕРАТУРА
1. Агаджанова А.А. Основные подходы к комплексной терапии антифосфолипидного синдрома в клинике невынашивания беременности // Акушерство и гинекология. — 1999. — № 3 — С. 6 8.
2. Айламазян Э.К. Роль иммунной системы фетоплацентарного комплекса в механизмах преждевременного прерывания беременности // Акушерство и гинекология. — 2004. — № 2 — С. 9–11.
3. Беньяминова А.Б. Клинико&гемостазиологические особенности у беременных с гестозами и антифосфолипидным синдромом: Автореф. дис. … канд. мед. наук. — М., 2006. — 24 с.
4. Венцківський Б.М. Невиношування вагітності: Зб. наук. праць МОЗ України. — К., 1997. — 236 с.
5. Венцківський Б.М. Про звичне невиношування вагітності при деяких формах гіпоплазії матки // Вісник акушера&гінеколога України. — 2001. — № 4 (14). — С. 9–15.
6. Голота В.Я., Бенюк В.О., Черненко В.Ю. та ін. Взаємообумовленість материнсько&плодових імунологічних відносин у генезі недоношування вагітності // Буковин. мед. вісник. — 2000. — № 3 — С. 57–59.
7. Демина Т.Н. Привычное невынашивание беременности и антифосфолипидный синдром: Автореф. дис. … д&ра мед. наук. — К., 1999 — 36 с.
8. Кузьменко Л.Г., Полетаев А.Б. Методы группы ЭЛИ-тест в клинической лабораторной практике: Информ. письмо. — М., 2004. — 17 с.
9. Макаров О.В., Озолиня Л.А. Антитела к кардиолипину и â2&гликопротеину&1 и невынашивание беременности // Рос. Вестник акушера-гинеколога. — 2004. — № 3. — С. 4–7.
10. Макацария А.Д. Тромбоцитарные состояния в акушерской практике. — М., 2004 — 310 с.
11. Марчин Л.Б., Флуд В.В. Корекція гемодинамічних розладів у функціональній системі мати—плацента—плід при загрозі передчасних пологів // Педіатрія, акушерство, гінекол. // 2006. — № 4. — С. 77–80.
12. Мурашко А.В. Медикаментозная терапия хронической венозной недостаточности во время беременности // Акушерство и гинекология. — 2006. — № 6. — С. 25–28.
13. Паращук Ю.С, Надер Х.Н., Дауд. Застосування препарату «Детралекс» при варикозній хворобі вен нижніх кінцівок у вагітних жінок // Вісн. наук. дослід. — 2005. — № 2. — С. 8–9.
14. Руденко А.Ю., Башкірова Л.М., Михайленко І.А. Солкосерил®: нові можливості застосування // Лікарська справа. — 2003. — № 516. — С. 77–79.
15. Солкосерил: нові можливості застосування / Руденко А.Ю. та ін. // Лікар. справа. — 2003. № 5/6. — С. 77–799.
16. Сидельникова В.М. Привычная потеря беременности. — М.: Триада-Х, 2002. — 304 с.
17. Шамсиев Ф.С., Мухамедов Х.Т. и др. Клинико&патогенетическое обоснование применения солкосерила у новорожденныхс перинатальной гипоксией // Рос. педиатр. журн. — 2001. — С. 53–56.
18. Stern C., Chamley R. Contemporary tendencies of antiphospolipid disorders // Am. J. Obst. Gynec. — 2006. — V. 6, № 37. — Р. 121–127.
19. Goldenberg R.L., John C. Intranterine infection and preterm delivery // N. Tngl. J. Med. — 2000. — V. 342, № 20. — Р. 1500–1505.
20. Coleman M., France J., Ananiev V. Prediction of pretorm labor // Am. J. Obst. Gynecol. — 2000. — V. 183, № 3. — Р. 643–648.
21. Gollinet F., Maillard F., Fulla Y. Biochemical markers of the risk of preterm delivery // Eur. J. Obst. Gynecol. Reprod. Biol. — 2005. — V. 94. — Р. 59–68.
Ключові слова: передчасні пологи, антифосфоліпідний синдром, гемостаз, мікроциркуляція, гіперкоагуляція, протеїн-С, інтерлейкін-3, солкосерил, детралекс.
Ключевые слова: преждевременные роды, антифосфолипидный синдром, гемостаз, микроциркуляция, гиперкоагуляция, протеин-С, интерлейкин-3, солкосерил, детралекс.
Key words: premature births, antifosfolipid syndrome, gemostas, microcirculation, hypercoagulation, Protein-S, interleykin-3, solkoseril, detraleks.
Реклама:
книги интернет магазин медицина, английский
билет автобус Европа
Транспортные новости и статьи
Книги верстка, макетирование, дизайн
интересные новости со всего мира
строительство и ремонт, недвижимость
качественно мини аборт с индивидуальным подходом
reno logan sandero
��� ������ � �����:
��������. ����������
���������� ����� ������:
http://old.medexpert.org.ua/modules/myarticles/article_storyid_169.html
�������:
�������� �����
������� ��������
��������. ������� �������
��������. ������� �������
|




