Ефективність профілактичної інтервенції у жінок з інсулінорезистентністю на ранніх термінах вагітності: результати клінічного дослідження
����: 2009/2/20 | ������: Здоровье женщины
С.І. Жук, В.І. Ошовський
Вінницький національний медичний університет ім. М.І. ПироговаВступ
Вагітність є станом, що характеризується зниженою чутливістю тканин до інсуліну. Під час фізіологічної вагітності її ознаки з'являються, почитнаючи із 16_го тижня гестації. У ІІ триместрі високий рівень оваріальних і плацентарних стероїдів, а також підвищення інтенсивності синтезу кортизолу корою наднирників сприяють поглибленню інсулінорезистентності, особливо з 24_го тижня вагітності [8, 15, 19, 23].
Основними причинами зниження чутливості тканин до інсуліну під час вагітності вважають: гормональні зміни, особливо за рахунок контрінсулярної дії деяких гормонів (плацентарного лактогену, пролактину, естрадіолу, кортизолу тощо); порушення капілярного кровоточу та трансендотеліального транспорту інсуліну до клітинмішеней; пострецепторний дефект обміну інсуліну, пов'язаний із порушенням фосфорилювання глюкозотранспортних білків; гіперплазовані b-клітини материнської підшлункової залози, які збільшують секрецію інсуліну майже втричі за рахунок гіпертрофії та гіперплазії [11, 14]. За відсутності сприятливих факторів для поглиблення інсулінорезистентності та ускладнень вагітності такі зміни не виходять за межі фізіологічних і не викликають патологічних процесів у організмі жінки та плоду. З іншого боку (наприклад, у випадках первинної інсулінорезистентності, вісцерального ожиріння, малорухомого способу життя), зниження чутливості периферичних тканин до дії інсуліну може поглиблюватись і набувати патологічних рис (Шустов А., 2001; Мулярчик О. та ін., 2002). Такий стан призводить до розвитку компенсаторної гіперінсулінемії, гіперглікемії та дисліпідемії. Вагітність створює умови для достатньо тривалої дії цих факторів, що поступово викликають активацію симпато-адреналової системи, гальмують експресію NO через блокування фосфатиділ-3-кінази, сприяють затримці іонів Na+ та рідини, спричиняють ендотеліальну дисфункцію, тромбофілію і, як наслідок, порушення інвазії трофобласта та утворення мікротромбозів у судинах плаценти [7, 8].
Вплив інсулінорезистентності, що визначена у ранні терміни гестації, на перебіг вагітності та пологів вивчався у рамках проспективного когортного дослідження на базі Вінницького національного університету ім. М.І. Пирогова та Вінницької обласної клінічної лікарні в період 2005–2006 роки. У досліджені було доведено, що інсулінорезистентність є досить поширеним станом у жінокмешканок Вінницької області, які народжували вперше. Такий стан має риси спадковості і може самостійно або у комплексі з іншими чинниками підвищувати акушерські та перинатальні ризики. Продемонстровано, що патологічний вплив інсулінорезистентності частково обумовлений порушенням обміну вуглеводів, дисліпідемією та тромбофілією на тлі фізіологічного зниження чутливості тканин до інсуліну після 12_го тижня гестації. Показано, що корекція інсулінорезистентності має розпочинатися до і продовжуватися впродовж вагітності. Така корекція передбачає активний руховий режим, дієтичне харчування та прийом ліків. Заходи спрямовані на підвищення чутливості тканин до інсуліну й усунення метаболічних порушень у вагітних жінок (Жук С., Ошовський В., 2007). Дослідження стало передумовою для розробки відповідної програми і перевірки її клінічної ефективності.
Мета дослідження — з'ясувати ефективність профілактичної інтервенції у вагітних з інсулінорезистентністю, спрямованої на попередження ускладнень вагітності та пологів.
Матеріал і методи дослідження
Рандомізоване відкрите (неосліплене) контрольоване клінічне дослідження проводилося на базі кафедри акушерства та гінекології № 1 Вінницького національного медичного університету, Центру планування сім'ї та репродукції людини, Відділення патології вагітних Вінницької обласної клінічної лікарні ім. М.І. Пирогова, Вінницького обласного ендокринологічного диспансера, акушерських стаціонарів центральних районних лікарень області з липня 2006 по травень 2007 року. У дослідженні брали участь 110 вагітних жінок віком 17–34 років, які народжували вперше у місті Вінниця та Вінницькій області в період з грудня 2006 до травня 2007 року. Із загальної кількості учасниць дослідження 70 жінок мали знижену чутливість до інсуліну і склали основну групу; 40 жінок не мали інсулінорезистентності і були зараховані до групи зовнішнього контролю.
Критеріями включення в основну групу були: інсулінорезистентність за індексом HOMA, відсутність пологів у анамнезі, згода жінки на участь у досліджені, термін вагіт ності до 12-ти тижнів на момент обстеження; постійне проживання у Вінниці або Вінницькій області. У дослідження не включалися жінки із тяжкою соматичною патологією (комбіновані вади серця з вираженою серцевою недостатністю, гіпертонічна хвороба ІІІ ступеня, цукровий діабет 1_го і 2-го типів, інші захворювання), яка передувала вагітності. Жінки з пологами в анамнезі не зараховувалися у зв'язку з прагненням позбутися можливих випадків впливу паритету на частоту акушерських ускладнень, а також для виключення інсулінорезистентності, що набула патологічних рис протягом попередніх вагітностей.
Спостереження за контрольною групою мало на меті підтвердження результатів когортного дослідження про негативний вплив інсулінорезистентності на перебіг вагітності та пологів. Жінки, які були зараховані до контрольної групи, мали складати гомогенну сукупність з основною групою, тобто бути максимально наближеними за віковими, антропометричними показниками, станом соматичного здоров'я, відповідати усім вищезазначеними критеріям, окрім наявності інсулінорезистентності.
Жінкам, які відповідали критеріям включення у дослідження, було запропоновано пройти опитування (анамнез життя, захворювань, сімейний) та відповідне клініколабораторне обстеження. Схема першого клініко-лабораторного обстеження (12 тиж. гестації) включала повне фізикальне обстеження із визначенням антропометричних показників, оцінка вітальних функцій, проведення загального та біохімічного аналізу крові, визначення концентрацій глюкози, тощакового інсуліну, С-пептиду, загального холестеролу, холестерину ліпопротеїдів високої та низької щільності, тригліцеридів, активованого часткового тромбінового часу (АЧТЧ), протромбінового індекса; загального аналізу крові, мазків на флору та цитологію. Дослідження біохімічних показників крові виконувалися в лабораторії Вінницького обласного ендокринологічного диспансеру, решта — на базі Вінницького обласного центру планування сім'ї та репродукції людини.
Кожна жінка проходила УЗД для підтвердження факту вагітності, визначення гестаційного терміну, стану ембріона, виключення патологічних відхилень з боку репродуктивної сфери. Такі обстеження проводилися у термінах 24 та 36 тижнів гестації, що обумовлено динамікою фізіологічних змін чутливості до інсуліну. Відомості про вагітну, отримані під час кожного візиту, занотовували у спеціально розроблений паспорт масиву, що зберігався у форматі ASCII і міг бути експортований до SPSS. У подальшому до масиву заносилася інформація про перебіг вагітності, відхилення щодо фізіологічних норм, фармакологічні втручання, перебіг пологів, оперативну допомогу, ускладнення вагітності, дані про дитину, перебіг раннього післяпологового періоду.
Після процедури стратифікації вагітні були рандомізовані за допомогою генератора випадкових чисел на 2 групи порівняння: І — 35 жінок з інсулінорезистентністю, які брали участь у профілактичній програмі, ІІ — 35 вагітних, які спостерігалися паралельно, без специфічних втручань.
Статистична обробка отриманих даних виконувалася на персональному комп'ютері «IBM Pentium IIІ» у статистичних пакетах «ОСА» та «SPSS 13» (SPSS Inc.), що належить Американському представництву в Україні «Програми оптимальних технологій в охороні здоров'я» (ліцензія № АXX910A374605FA). Обробка та систематизація даних виконана у середовищі «Windows XP Home Edition Microsoft Corp. USA» (ліцензія № 55274-640-2543905-23042) за допомогою пакету офісних програм «Microsoft Office XP Microsoft Corp. USA» (ліцензія № 51408-000-0000-746-02422).
Усі кількісні анамнестичні, клінічні, лабораторні і інструментальні дані оброблені методами варіаційної статистики. Для кожного кількісного параметра були визначені: середнє значення, середнє квадратичне відхилення, помилка середнього, медіана, 95% довірчий інтервал; для якісних даних — частоти (%).
Для порівняння параметричних даних (після перевірки кількісних даних на нормальний розподіл за допомогою тестів Колмогорова—Смірнова і Шапіро—Вілка) використовували метод ANOVA (для декількох груп) і t-критерій Ст'юдента для 2-х незалежних вибірок. Для порівняння непараметричних даних застосовували методи Круаскела—Уолліса (для декількох груп) та Менна—Уїтні для 2-х груп незалежних сукупностей. Для порівняння гомогенності дисперсій у порівнюваних групах використовувався тест Левена. Окрім того, проводився мультифакторний дисперсійний аналіз, заснований на порівнянні внутрішньогрупових і міжгрупових дисперсій при 95%-му рівні значущості (р<0,05). Для знаходження відмінностей між якісними показниками визначалися співвідношення шансів (Odds Ratio) використовували метод визначення ÷2 (Пірсона) з поправкою Йетса на безперервність, для обчислення якого вдавалися до побудови сітки «2 х 2», а також критерії Фішера та Крамера для визначення сили зв'язку. Статистично значущими вважалися відмінності при р<0,05 (95%-й рівень значущості) і при р<0,01 (99%-й рівень значущості). Зв'язок між показниками, що вивчалися, оцінювався за результатами кореляційного аналізу з обчисленням коефіцієнта кореляції Пірсона (r) або Спірмена (R) і подальшим встановленням його значущості за t_критерієм Ст'юдента. При розробці стратегії профілактичної інтервенції ставилися такі вимоги:
- патогенетична обґрунтованість заходів;
- можливість впровадження під час вагітності;
- комплексність, простота, доступність, універсальність;
- можливість проведення моніторингу та оцінки програми.
Раціоналізація харчування
Дієтичне харчування є основною вимогою до будьяких заходів, що спрямовані на підвищення чутливості тканин до інсуліну [1, 2, 5, 6]. Виходячи з того, що цільовою групою дослідження є вагітні, метою раціоналізації харчування не було зменшення маси тіла, оскільки на даному етапі це могло викликати несприятливі умови для розвитку плода, обмінні порушення, гіпертензію, психологічні стреси. Харчування мало бути доступним, приємним, нескладним, таким, що адекватно забезпечує розвиток плода та енергетичні процеси в організмі жінки, з іншого боку, не сприяти надлишковому набору ваги та поглибленню інсулінорезистентності.
Основними принципами запропонованого харчування були: структурований режим прийому, сбалансованість вуглеводів, білків, жирів, мінералів та вітамінів, а також оптимізація їхніх джерел, адекватне водне навантаження. Так, наприклад, був запропонований частий прийом їжі невеликими порціями (до 6 разів на добу, останній раз за 1,5 години до сну), загальний калораж — 1700–2000 кКал в залежності від індекса маси тіла, але не менше ніж 1500 кКал. Основою раціону (50–60% харчової цінності) повинні бути складні вуглеводи зі зниженим глікемічним індексом; загальна кількість жирів мала не перевищувати 30% від загального калоражу, із них сатурованих жирів — 10%, кількість білків тваринного та рослинного походження мала складати не менше 70–80 г на добу. Рекомендувалося включати до раціону продукти, багаті на клітковину, вживати не менше 2-х літрів рідини на добу.
Жінкам були запропоновані таблиці розрахунку харчової цінності, приклади раціонів та набір рекомендованих меню, розроблених у співпраці з лікарями-дієтологами.
Руховий режим
Раціоналізація харчування має бути обов'язково підкріплена зміною рухового режиму у бік більш активного. Чисельні дослідження демонструють, що лише поєднання дієти з активним способом життя здатне суттєво зменшити інсулінорезистентість [1, 5, 11]. В окремих випадках таке поєднання є не менш ефективним, ніж тривала медикаментозна терапія [2, 5, 14]. М'язова діяльність є основним споживачем глюкози та інших енергетичних субстратів, отже сама по собі сприяє нормалізації глікемії та концентрації інсуліну [6]. Інші дослідження демонструють підвищення кількості і функціональної активності траспортера глюкози GLUT-4 [7, 14].
Вагітним був рекомендований комплекс щоденних вправ, який був пристосований до змін в організмі жінки протягом гестації. Основою комплексу була щоденна 30-хвилинна ходьба (плавання, катання на лижах) і набір аеробних вправ, розроблених, спільно із спеціалістами лікувальної фізкультури. Основним принципом було виконання додаткових фізичних навантажень, еквівалентних за енергетичними витратами не менше, ніж 100 кКал і, водночас, не більше 200 кКал.
Жінкам були запропоновані таблиці розрахунку енергетичних втрат і приклади комплексних вправ.
Забезпечення підтримки, моніторингу та оцінки
З метою можливості здійснення контролю (як зовнішнього, так і самостійного) за дотриманням принципів раціонального харчування, рухового режиму та медикаментозної терапії усім жінкам були запропоновані спеціально розроблені щоденники. Кожен щоденник складався із таблиць, де відмічалися спожиті і втрачені калорії, вжиті препарати, різні аспекти прийнятності програми, власні почуття, коментарі. Окрім того, щоденник містив текстові рекомендації, раціони, комплекси вправ.
Одним із додаткових принципів профілактичної інтервенції було залучення партнерів (чоловік, сестра, мати, подруга) для підтримки вагітної з метою чіткого слідування щодо дотримання всіх рекомендацій програми. Із партнерами проводився тренінговий семінар, на якому викладалися не тільки основи їхньої ролі при виконанні профілактичної інтервенції, але й принципи дії у випадках появи тривожних симптомів з боку вагітної чи плода.
Медикаментозний компонент
І. Використання депротеїнізованих гемодериватів (Актовегін, Солкосеріл) в акушерстві має тривалу історію. Здатність мобілізувати енергетичні ресурси клітин, антиоксидантні властивості та покращувати захоплення й утилізації кисню були основним аргументом для використання цих препаратів з метою покращення материнсько-плодового кровотоку при плацентарній дисфункції, затримці внутрішньоутробного розвитку плода, прееклампсії та інших патологічних станах [9]. Особливу цікавість викликають дослідження, які свідчать про наявність у даної групи препаратів (зокрема, Актовегін) інсуліноподібного ефекту, обумовленого інозітолфосфатолігосахаридами - активаційними транпортерами глюкози у плазматичній мембрані (GLUT 1–5) [3, 4]. Завдяки наявності гліколіпідів у складі препарату, дія на переносчики глюкози відбувається без впливу на інсулінові рецептори, що особливо актуально в умовах зниженої чутливості до інсуліну [10].
Експериментальним шляхом встановлено, що інозітолфосфатолігосахаридами не тільки активують транспорт глюкози, але й стимулюють дію деяких ключових ферментів у циклі Кребса (зокрема, піруватдегидрогенази). Підсилений потік пірувата призводить до стимуляції синтезу ацетилкоензима_А - найважливішого нейромедиатора [3, 4]. Окрім того, існують дослідження, де продемонстровано безпосередній вплив Актовегіну на інсулінорезистентність, чим обумовлено його застосування при цукровому діабеті 2_го типу та метаболічному синдромі (Jacobs М., Heidrich Н., Quednau Т., 1999).
Враховуючи вищезазначене, а також тривалий досвід використання препарату під час вагітності, оральна форма Актовегіну була обрана у якості складової терапії у жінок зі зниженою чутливістю до інсуліну. Прийом препарату призначався пацієнткам, починаючи з 24-го по 36-й тиждень гестації, за схемою: 2 таблетки 3 рази на добу протягом 15-ти днів із перервою на 2 тижні, 3 курси по 15 днів.
ІІ. Вагітність є станом, що характеризується підвищеною потребою в іонах магнію, який є каталітичним регулятором більшості відомих нейропептидів головного і спинного мозку [16, 17]. Препарати магнію протягом багатьох років незмінно відносяться до найпоширеніших в акушерській практиці, де, в основному, використовується їх токолітична, гіпотонічна та седативна дія. Однак було доведено, що дефіцит магнію відіграє значну роль у патогенезі формування глюкозотолерантності та цукрового діабету 2_го типу [18, 20]. Окрім того, експериментальними, клінічними та епідеміологічними дослідженнями переконливо продемонстровано негативний вплив через нестачу магнію при виникненні інсулінорезистентності [16, 20, 21]. Низький рівень магнію призводить до змін у судинному тонусі, спричиняє гіпертензивні порушення, погіршення периферичного кровотоку, що, в свою чергу, знижує чутливість тканин до інсуліну.
Гіперінсулінемія стимулює синтез ангіотензина-ІІ і активацію ренін-ангіотензин-альдостеронової системи, що замикає «порочне коло» [17, 18]. Виходячи із цих даних, було вирішено включити препарати солей магнію до профілактичної програми. Дозування базувалося на добовій потребі, що складає 300 мг у перерахунку на магній (наприклад, 6 таблеток Магне-B6). Прийом препарату рекомендувався з 16-го по 36-й тиждень вагітності за схемою: 300 мг щоденно протягом 15-ти днів із перервою на 2 тижні, всього - 4 курси, які, починаючи з 24-го тижня, чергували із прийомом Актовегіну.
ІІІ. У вагітних жінок відмічається підвищена потреба у фолієвій кислоті [22, 24]. Використання цього вітаміну з метою зниження частоти виникнення дефектів у нервовій трубці ембріона доведено багатьма дослідженнями найвищого рівня [5, 7]. Крім того, фолієва кислота має потужні антиоксидантні властивості, вона як один із ключових кофакторів обміну гомоцистеїну здатна нормалізувати його рівень і впливати на розвиток ендотеліальної дисфункції [22, 24, 25]. Ендотеліальної дисфункції тісно пов'язана з питанням чутливості периферичних тканин до інсуліну, також доведено роль гіперглікемії та гіперінсулінемії у формуванні ендотеліальної дисфункції із подальшим утворенням каскаду патологічних реакцій з боку серцево-судинної системи. З іншого боку, власне патологія ендотелія і поглиблює нечутливість тканин до інсуліну [25]. Поряд із цим, сьогодні досить добре вивчена роль гіпергомоцистеїнемії у порушенні інвазії трофобласту і тромбофілічних станах під час вагітності [5, 6].
Виходячи із викладеного, було прийняте рішення включити препарати фолієвої кислоти до профілактичної програми. Дозування базувалося на денних потребах вагітної і складало 600 мг на добу. Схема прийому: 600 мг таблетованих форм фолієвої кислоти щоденно (з 12-го по 16-й тиждень вагітності — приблизний термін завершення формування плаценти).
Результати досліджень та їх обговорення
Протягом грудня–травня 2007 року у 110 жінок із середнім віком 22,85 років народилося 110 дітей із середнім терміном гестації 38,34 тижні. Відмінностей у тривалості вагітності між групами виявлено не було. Перинатальних втрат не зафіксовано. Усі 110 жінок перебували під спостереженням від початку до кінця дослідження. І група складалася із 35 осіб, у яких виявлено інсуліноре зистентність, і вони брали участь у профілактичній інтервенції; ІІ група складалася із 35 осіб, які мали інсулінорезистентність, проте профілактичної інтервенції не проходили (у випадку ускладнень отримували традиційну симптоматичну терапію); ІІІ група — 40 жінок без інсулінорезистентності, співставимі з І і ІІ групами за антропометричним і соматичним статусом.
Виходячи із показників індексів HOMA, McAuley, QUICKI, стартовий рівень інсулінорезистентності у І і ІІ групах був однаковим. При порівнянні індексів у динаміці (24–36 тиж. гестації) було виявлено відмінності між середніми показниками (p=0,00). Так, чутливість до інсуліну була вищою у жінок І групи, які були залучені до профілактичної інтервенції. Цей факт опосередковано підтверджується відмінностями у середніх показниках приросту ваги, систолічного тиску, тромбофілії, обміну вуглеводів та ліпідів.
Приріст ваги та обводу стегон
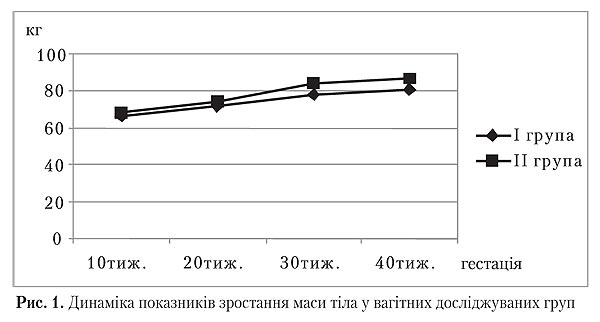
При включенні у дослідження вагітних із терміном гестації 12 тижнів середня вага у жінок І групи досягла значень 66,51±5,43 кг, у ІІ — 68,42±5,56 кг. Дані показники були співставимі і не мали значущої різниці (p>0,05). Під час другого дослідження (24 тижні) цей показник становив 5,05±0,8 і 5,7±1,4 кг відповідно, що мало значущі відмінності (p=0,001). Найбільш вагомі відмінності у середніх показниках приросту маси тіла були зафіксовані під час третього дослідження (36 тижнів) і склали 6,65±1,87 кг у І групі та 10,25±2,68 кг — у ІІ (р=0,00). Приріст ваги протягом останніх тижнів вагітності не мав відмінностей і склав 2,7±0,68 і 2,8±0,8 кг відповідно (р=0,63). Загальний приріст ваги, починаючи з 12-ти тижнів гестації, склав 14,5±2,94 і 18,7±2,82 кг (p=0,00).
Під час залучення жінок у дослідження у терміні вагітності 12 тижнів середні показники обводу стегон становили в І групі 99,28±4,22 см, а в ІІ — 100,38 ±1,94 см, тобто не мали значущої різниці (p>0,05). Під час другого дослідження (24 тижні) приріст обводу стегон у І і ІІ группах склав 4,47±2,76 і 2,91±1,01 см відповідно, що мало значущі відмінності (p=0,003). Згодом значущих відмінностей у середніх показниках приросту обводу стегон під час третього дослідження (36 тижнів) та напередодні пологів (p>0,05) відмічено не було. Однак загальний приріст обводу стегон достовірно відрізнявся і в І групі досягав 5,68±,71 см, а в ІІ — 7,95±3,2 см (p=0,00).
Під час залучення жінок у дослідження у терміні вагітності 12 тижнів середні показники обводу стегон становили в І групі 99,28±4,22 см, а в ІІ — 100,38 ±1,94 см, тобто не мали значущої різниці (p>0,05). Під час другого дослідження (24 тижні) приріст обводу стегон у І і ІІ группах склав 4,47±2,76 і 2,91±1,01 см відповідно, що мало значущі відмінності (p=0,003). Згодом значущих відмінностей у середніх показниках приросту обводу стегон під час третього дослідження (36 тижнів) та напередодні пологів (p>0,05) відмічено не було.
Однак загальний приріст обводу стегон достовірно відрізнявся і в І групі досягав 5,68±,71 см, а в ІІ — 7,95±3,2 см (p=0,00).
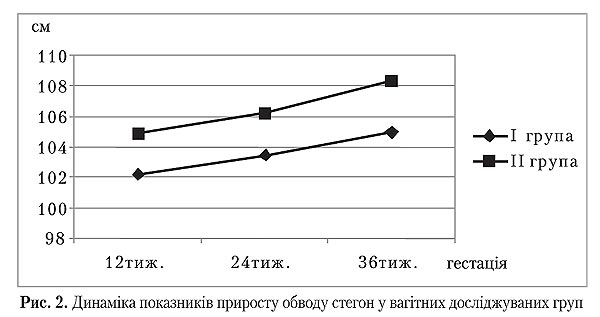
Описані спостереження вважаємо цікавими, оскільки вони відображають не зовсім типові зміни антропометрії у порівнянні з загальною популяцією жінок. Так, основний приріст ваги у групах припав на період 24–36 тижні вагітності, що не корелює із приростом обводу стегон, пік якого припав на період 12–24 тижні. Таке явище можна пояснити, беручи до уваги той факт, що інсулінорезистентність, як правило, супроводжується вісцеральним типом ожиріння. Імовірно, приріст маси тіла відбувається переважно за рахунок абдомінальних, а не підшкірних жирових відкладень, що, безумовно, є прогностично менш сприятливим для відновлення у післяпологовому періоді.
Концентрація глюкози та інсуліну
При включенні у дослідження рівень глікемії у вагітних жінок із терміном гестаціїї 12 тижнів в обох группах був подібним (р>0,05). Під час усього подальшого спостереження між І і ІІ групами фіксувалися значущі відмінності середніх значень концентрації глюкози в крові (р=0,00). Проте у ІІ групі при незначному підвищенні середнього рівня інсуліну під час динамічного спостереження відбувалося суттєве збільшення концентрації глюкози, що може свідчити про поглиблення інсулінорезистентності у 24 тижні вагітності. Навіть фізіологічне покращення чутливості тканин до інсуліну на пізніх термінах не дало можливості зрівняти середні показники глікемії у групах порівняння. Поступове рівномірне зменшення глікемії в І групі може свідчити про ефективність інтервенції, яка підсилюється з часом шляхом фізіологічного зменшенням потреб вагітних в інсуліні.

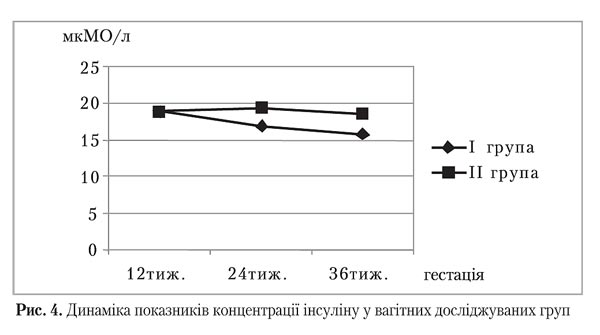
У терміні вагітності 12 тижнів жінки обох груп були подібними за концентрацією інсуліну (р>0,05). Під час усього подальшого спостереження між І і ІІ групами фіксувалися значущі відмінності середніх показників його концентрації (р=0,00). У ІІ групі спостерігалася незначна, проте стабільна тенденція до зростання вмісту інсуліну, що може свідчити про збільшення потреби в інсуліні через фізіологічне зменшення чутливості до його дії у периферичних тканинах. Навіть після поступового відновлення рівня інсуліну наприкінці вагітності, що відповідає фізіологічним механізмам її перебігу, середні значення рівня інсуліну мають достовірно значимі відмінності між групами.
Концентрації загального холестерину та ХС ЛПНЩ
На початку дослідження у терміні вагітності 12 тижнів жінки обох груп були подібними за вмістом загального холестерину та ХС ЛПНЩ (р>0,05). Під час усього подальшого спостереження між І і ІІ групами фіксувалися відмінності їх середніх значень (р<0,05), що дозволило прослідкувати рівномірне зниження вмісту загального холестерину та ХС ЛПНЩ в обох групах протягом усього періоду спостереження. Проте зниження концентрації загального холестерину у ІІ групі наприкінці вагітності корелювавло зі зниженням тощакового інсуліну і глікемії, що були представлені раніше.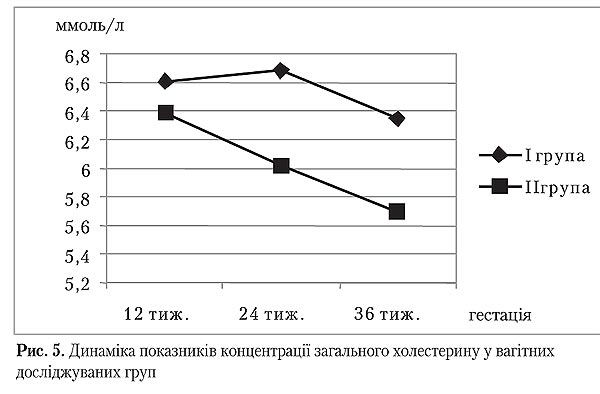
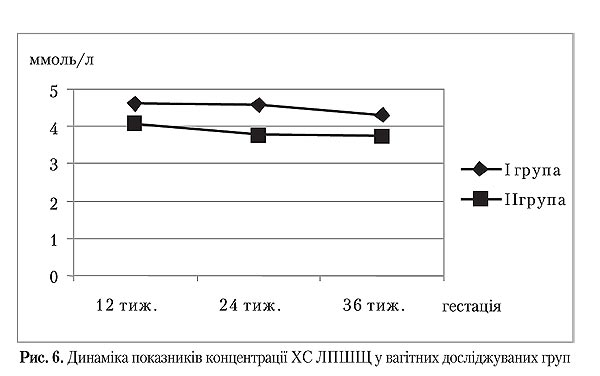
Слід відмітити, що більшість літературних джерел пов'язують гіперінсулінемію з гіпертригліцеридемією, що не було підтверджено у нашому дослідженні. Однак існують роботи, які вказують, що навіть незначне збільшення ХС ЛПШЩ на nks інсулінорезистентності створює високу атерогенну ситуацію, оскільки часточки ЛПНЩ в таких умовах вирізняються меншим розміром, щільнішимхолестериновим ядром і легше захоплюються відповідними рецепторами з кровотоку [5].
Динаміка показників коагуляційного потенціалу
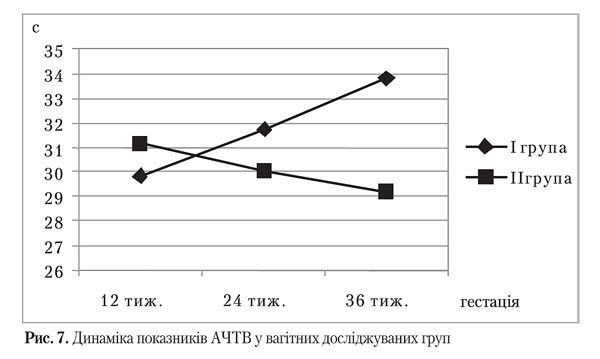
У ході дослідження значущої різниці середніх протромбінового індексу зафіксовано не було. Однак, незважаючи на граничні щодо нормативів значення АЧТВ в обох групах, спостерігалося поступове зменшення АЧТВ у ІІ групі, що достовірно відрізнялося від ситуації, що склалася у І групі із поступовим зростанням АЧТВ (р=0,00).
Отримані дані свідчать про більшу схильність до тромбофілії вагітних із групи, яка не брала участі у профілактичній програмі.
Отже, за допомогою лабораторних та антропометричних досліджень вдалося підтвердити позитивний вплив профілактичної програми на чутливість тканин до інсуліну і його метаболічні ефекти, а саме, обмін вуглеводів, ліпідів і опосередковану участь у процесах коагуляції. Крім того, участь у профілактичній програмі дозволила зменшити частоту виникнення артеріальної гіпертензії вагітних, прееклампсії легкого ступеня, дистресу плода (p<0,05). Можливо, за рахунок зниження частки дистресів у І групі кількість операцій кесаревого розтину і необхідність проведення новонародженим інтенсивної терапії були меншими (табл. 1).
Порівняльний аналіз перебігу вагітності та пологів, а також лабораторних та антропометричних даних у пацієнток ІІ і ІІІ груп підтвердив результати когортного дослідження, що інсулінорезистентність в ранніх термінах гестації є незалежним фактором негативного впливу на соматичний та акушерський статус вагітних жінок (табл. 2).
З метою оцінки індивідуального впливу компонентів програми був проведений ретельний аналіз щоденників, які заповнювали протягом дослідження жінки І групи. Мета аналізу — з'ясувати рівень дисциплінованості у виконанні немедикаментозного компоненту. Усіх жінок було умовно розподілено на 3 групи відповідно до виконання рекомендацій щодо раціонального харчування, водного та рухового режимів: І група — 20 (57,14%) пацієнток, які виконували рекомендації протягом дослідження в об'ємі 80% і більше, ІІ група — 8 (22,86%) пацієнток з об'ємом виконання 60–80% і ІІІ група — 7 (20%) вагітних, які виконали лише 60% і менше рекомендованих процедур. При порівнянні середніх значень для декількох вибірок було встановлено залежність між об'ємом немедикаментозного втручання і приростом ваги, показниками обміну глюкози, ліпідного спектру та гемостатичної системи (р<0,05). Так, позитивні зміни були більш характерні для вагітних, де рекомендації виконувалися в об'ємі понад 80%. Окрім того, доведено значиму різницю між группами щодо кількості ускладнень перебігу вагітності та пологів в залежності від інтенсивності не медикаментозної інтервенції. Так, у групі, де жінки були менш дисциплінованими, частіше відмічалися прееклампсії легкого ступеня, плацентарна недостатність, первинна слабкість пологової діяльності (р<0,05). З іншого боку, показники обміну у цій групі були кращими, ніж у вагітних, які не брали участі у профілактичній інтервенції, що свідчить про комплексну дію медикаментозного та немедикаментозного компонентів терапії. Слід відмітити, що під час опитування породіль 29 (82,6%) із них визнали доцільність та ефективність застосованої профілактичної стратегії, 4 (11,43%) жінки відмітили незначні складності при виконанні рекомендацій, 2 (5,7%) вважали профілактичну інтервенцію занадто складною, 88,57% пацієнток відмітили, що для належного дотримання принципів інтервенції було винятково важливим мати підтримку з боку підготовленого партнера.
Висновки
1. Інсулінорезистентність в ранніх термінах гестації є фактором негативного впливу на вагітність, пологи та соматичний статус породіллі, що підтверджується даними когортного дослідження.
2. Профілактична стратегія, що складається з раціонального харчування, активного рухового режиму, самоконтролю жінки (заповнення спеціального щоденника), активного залучення партнера, а також патогенетичної медикаментозної терапії, може покращити показники чутливості до інсуліну, запобігти надлишковому приросту ваги, розвитку артеріальної гіпертензії, дисліпідемії, порушень обміну вуглеводів, тромбофілії, зменшити частоту гіпертензивних розладів у вагітних, дистресів плода, оперативного розродження і потреби в інтенсивній терапії
новонароджених.
3. Визначення інсулінорезистентності в ранніх термінах вагітності має проводитися серед усіх жінок, які мають обтяжений спадковий анамнез щодо цукрового діабету, ожиріння, гіпертонічних розладів та патології серцево-судинної системи у репродуктивному віці, обтяжений власний анамнез щодо порушень менструального циклу, непліддя, склерополікистозу яєчників, патології статевого дозрівання або інших гормональних порушень, надлишкову вагу, гіпертензію, порушення толерантності до глюкози, а також тромбофілічні розлади на момент обстеження.
ЛІТЕРАТУРА
1. Адашева Т.М., Демичева О.Ю. Метаболический синдром: основы патогенетической терапии // Лечащий врач. — 2003. — № 10. — С. 24–28.
2. Бутрова С.А. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению // РМЖ. — 2001. — № 9 (2). — С. 56–60.
3. Гурьева И.В., Креминская В.М. Возможность применения актовегина при поздних осложнения сахарного диабета // РМЖ. — 2004. — № 9.
4. Громова О.А., Панасенко О.М., Скальный А.В. Нейрохимические механизмы действия современных нейропротекторов природного происхождения (элементный анализ и ферментативная антиокислительная активность) / В кн.: Актовегин. Новые аспекты клинического применения. — М., 2002.
5. Макацария А.Д., Пшеничникова Е.Б., Пшеничникова Т.Б., Бицадзе В.О. Метаболический синдром и тромбофилия в акушерстве гинекологии. — М.: Мед. информ. агенство, 2006. — 476 с.
6. Манухин И.Б., Геворкян М.А., Чагай Н.Б. Ановуляция и инсулинорезистентность. — М.: ГЭОТАР_Медиа, 2006. — 416 с.
7. Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Клинические лекции по гинекологической эндокринологии. — М.: МИА, 2001. — 248 с.
8. Мулярчик О.В., Забаровская З.Б., Тишковская О.В. Этиопатогенетические аспекты изменений углеводного обмена при физиологически протекающей беременности и гестационном сахарном диабете // БМЖ. — 2002. — № 2. — С. 19–23.
9. Сидорова И.С., Макаров И.O. Фетоплацентарная недостаточность. Клинико_диагностические аспекты. — М.: Знание, 2000. — С. 126.
10. Сыч Ю.П., Зилов А.В. Возможности применения Актовегина в лечении сахарного диабета // Проблемы эндокринологии. — 2003. —№ 3 (49). — С. 51–53.
11. Шестакова М.В., Брескина О.Ю. Инсулинорезистентность: патофизиология, клинические проявления, подходы к лечению // Consilium medicum. — 2002. — Т. 4, № 10. — С. 523–527.
12. De Stefano V., Casorelli I., Rossi E. et al. Interaction between hyperhomocystinemia and inherited thrombophilic factors in venous thromboembolism //
Semin Thromb Hemost. — 2000. — № 26. — Р. 305.
13. Doshi S.N., McDowell I.F., Moat S.J. et al. Folic acid improves endothelial function in coronary artery disease via mechanisms largely independent of
homocysteine lowering // Circulation. — 2002.— V. 105. — Р. 22.
14. Granberry M.C., Fonseca V.A. Insulin resistance: basics of therapy // Southern Medical Journal. — 1999. — V. 92, № 1. — Р. 2–14.
15. Homko С., Sivan E., Chen X. et al. Insulin secretion during and after pregnancy in patients with gestational diabetes mellitus // Journal of Clinical Endocrinology & Metabolism. — 2001. — V. 96, № 2. — Р. 568–573.
16. Liese A.D., Roach A.K., Sparks K.C. et al. Whole_grain intake and insulin sensitivity: the Insulin Resistance Atherosclerosis Study // American Journal of Clinical Nutrition. — 2003. — V. 78, № 5. — Р. 965–971.
17. Lima Mde L., Pousada J., Barbosa C. et al. Magnesium deficiency and insulin resistance in patients with type 2 diabetes mellitus // Arq. Bras. Endocrinol. Metabol. — 2005. —V. 49, № 6. — Р. 959–963.
18. Lopez_Ridaura R., Willett W.C., Rimm E.B. et al. Magnesium intake and risk of type 2 diabetes in men and women // Diabetes Care. — 2004. — V. 27. — Р. 134–140.
19. Pouta A., Hartikainen A.L., Sovio U. et al. Manifestations of metabolic syndrome after hypertensive pregnancy // Hypertension. — 2004. — V. 43 (4). — Р. 825–31.
20. Rayssiguier Y., Gueux E., Nowacki W. et al. A high fructose consumption combined with low dietary magnesium intake may increase the incidence of the metabolic syndrome by inducing inflammation // Magnesium Research. — 2006. — V. 19, № 4. — Р. 237–243.
21. Rumawas M.E. et al. Magnesium intake is related to improved insulin homeostasis in the framingham offspring cohort // Journal of the american colle_
ge of nutrition. — 2006. — V. 25, № 6. — Р. 486–492.
22. Setola E., Monti L.D, Galluccio E. Insulin resistance and endothelial function are improved after folate and vitamin B12 therapy in patients with metabolic syndrome: relationship between homocysteine levels and hyperinsulinemia // European Journal of Endocrinology. — 2003. — V. 151, is. 4. — Р. 483–489.
23. Sivan E., Homko C., Whittaker G. et al. free fatty acids and insulin resistance during pregnancy // Journal of Clinical Endocrinology & Metabolism. 1998. — V. 93, № 7. — Р. 2338–2342.
24. Shinozaki K., Hirayama A., Nishio Y. et al. Coronary endothelial dysfunction in the insulin_resistant state is linked to abnormal pteridine metabolism and vascular oxidative stress // J. Am. Coll. Cardiol. — 2001. — V. 38. — Р. 1821.
25. Stroes E.S., van Faassen E.E., Yo M. et al. Folic acid reverts dysfunction of endothelial nitric oxide synthase // Circ Res. — 2000. — V. 86. — Р. 1129.
Ключевые слова: рандомизированное открытое контролируемое исследование, инсулинорезистентность, патология беременности, профилактическая стратегия.
Ключові слова: рандомізоване контрольоване клінічне дослідження, інсулінорезистентність, патологія вагітності, профілактична інтервенція.
Key words: randomized opened controlled clinical study, insulin resistance, pregnancy pathology, preventive strategy.
Реклама:
книги купить медицина, английский
английский язык Оксфорд учебники для детей и взрослых
А.А.Тимофеев стоматология медицинские книги
Акупунктура без иголок - центр тибетской медицины . Как правильно кормить ци.
��� ������ � �����:
��������. ����������
���������� ����� ������:
http://old.medexpert.org.ua/modules/myarticles/article_storyid_170.html
�������:
�������� �����
������� ��������
��������. ������� �������
��������. ������� �������
|









