Випадок діагностики сиреномелії з агенезією сечовивідної протоки і відповідним обтураційним синдромом у І триместрі при вагітности внаслідок допоміжних репродуктивних технологій (Опис випадку та огляд літератури)
����: 2009/8/14 | ������: Здоровье женщины
О.І. Соловйов, Я.А. Гончарова, Ю.В. Маслій, І.А.Cудома
Клініка репродуктивної медицини «НАДІЯ», м. Київ
Національна медична академія післядипломної освіти ім. П.Л. Шупика МОЗ України, м. Київ
Резюме. Наводиться приклад ультразвукової діагностики (УЗД) та фетоскопічного підтвердження випадку синдрому русалки (sirenomelia, сиреномелія) перед перериванням на 12 тижні вагітності у пацієнтки з вилікуваною за допомогою допоміжних репродуктивних технологій (ДРТ) через введення єдиного сперматозоїда безпосередньо до яйцеклітини (ICSI, intracytoplasmic sperm injection) первинною неплідністю. Синдром русалки є рідкісною летальною вадою розвитку, коли відбувається різного ступеню зрощення, викручування, атрофія чи гіпотрофія нижніх кінцівок, що поєднується з тяжкими урогенітальними аномаліями (здебільшого двобічною агенезією чи дисгенезією нирок, відсутністю сечового міхура), які призводять до значного маловоддя у ІІ триместрі. Наведений випадок є ще більш рідкісним і нетиповим з погляду на наявність у плода обох нирок, їх гідронефротичними змінами та значним збільшенням сечового міхура внаслідок атрезії сечовивідної протоки. Наразі другого такого випадку, описаного у доступній нам через Інтернет світовій медичній літературі, ми не знайшли. Зазвичай, головною метою поєднаних просівних досліджень І триместру, що виконуються від 11 тижнів 0 днів до 13 тижнів 6 днів, є оцінка особистих ризиків пацієнтки щодо хромосомних аномалій плода. Останніми роками при таких дослідженнях, використовуючи методологію КОДА (Клініка Одного Дня з оцінки Аномалій), все більшої уваги ми приділяємо одночасному ретельному огляду побудови тіла плода та оцінці ризиків можливих пізніших положничих ускладнень. Наш випадок доводить, що й такі рідкісні смертельні вади розвитку зі значною точністю можуть бути визначені вже в І триместрі. На підставі власних даних та аналізу світової літератури вважаємо, що найкращим способом діагностики синдрому русалки є УЗД, здійснене сааме в І триместрі вагітності під час поєднаного просівного дослідження.
Резюме. Приводится пример ультразвуковой диагностики (УЗД) в 12 недель и последующего фетоскопического подтверждения синдрома русалки (sirenomelia, сиреномелия) у пациентки с излеченным благодаря вспомогательным репродуктивным технологиям (ВРТ) с помощью введения единственного сперматозоида непосредственно в яйцеклетку (ICSI, intra-cytoplasmic sperm injection) первичным бесплодием. Синдром русалки является редким летальным пороком развития, при котором происходит различной степени сращение, поворот, атрофия или гипотрофия нижних конечностей, сочетающаяся с тяжелыми урогенитальными аномалиями (обычно встречаются двусторонняя агенезия или дисгенезия почек, отсутствие мочевого пузыря), которые приводят к выраженному маловодию во II триместре. Приведенный случай синдрома русалки является редким и нетипичным вследствие наличия обеих почек с гидронефротическими изменениями и значительно увеличенным мочевым пузырем. Другого такого случая, описанного в доступной нам через Интернет мировой медицинской литературе, мы не нашли. Обычно основной целью сочетанных просеивающих исследований I триместра, которые выполняются от 11 недель 0 дней до 13 недель 6 дней, является оценка личных рисков пациентки относительно хромосомных аномалий плода. В последние годы, используя методологию КОДА (Клиника Одного Дня для оценки Аномалий), мы все большее внимание уделяем одновременному тщательному изучению строения тела плода и оценке рисков возможных поздних акушерских осложнений. Наш случай показывает, что и такие редкие летальные пороки развития с высокой точностью могут быть обнаружены в I триместре. На основании собственного опыта и анализа мировой медицинской литературы считаем, что наилучшим способом диагностики синдрома русалки является УЗД, осуществленная именно в I триместре во время сочетанного просеивающего исследования.
Summary. We present the case of ultrasound diagnosis (USD) and fetoscopic confirmation of mermaid syndrome (sirenomelia) at 12 weeks GA in pregnancy after assisted reproductive technology (ART) with intracytoplasmic sperm injection (ICSI) due to primary infertility. The sirenomelia sequence is a rare and lethal anomaly characterized by fusion, rotation, hypotrophy or atrophy of the lower limbs and severe urogenital abnormalities (usually associated with the absence of bladder and agenesis or dysgenesis of kidneys) leading to oligohydramnios in the second half of pregnancy. Our case is not typical considering urethral atresia, megacystis and bilateral hydronephrosis presence. In fact there are no such cases presented in world medical literature available in Internet. Usually the main task of first trimester screening at 11+0 — 13+6 weeks is individual chromosomal abnormalities risk assessment. Using OSCAR (One Stop Clinic for Assessment of Risk of fetal anomalies) methodology last years we also place high emphasis on first trimester on simultaneous thorough anatomic survey of a fetus and on possible late obstetrical complications risk evaluation. Our case illustrates that during the first trimester of pregnancy, rare and lethal anomalies may be diagnosed with a high degree of confidence. Basing on own experience and having analyzed world medical literature we came to conclusion that the best method of mermaid syndrome diagnosis is USD made during combined screening examination in first trimester.
Вступ
Назва «sirenomelia» («сиреномелія», або ж «mermaid syndrome», тобто, «синдром русалки») походить від фізичної подібності ураженого плода до містичних істот русалок — чарівних жінок із нижньою частиною тіла у вигляді риб'ячого хвоста, коли має місце злиття нижніх кінцівок і часткове або повне злиття ступнів (рис. 1, 2).

Частота цієї вади розвитку, за даними різних авторів, складає від 1:24 000 до 1:100 000 народжених живими [32,44,46,48–50,56]. Проте ці дані можуть бути оманливими з огляду на подібність цієї вади до так званої каудальної дисплязії або регресії. У спеціальній літературі є протиріччя щодо визнання сиреномелії окремим хворобливим станом чи виразною формою синдрому каудальної регресії [15,42,49,53,54,56]. Проте, наявність двох артерій пуповини, сумісних із життям вад розвитку нирок, розділених нижніх кінцівок, дефектів черевної стінки, а також аномалій трахеоезофагального дерева і нервової трубки та серця дозволяють відрізнити синдром каудальної регресії від сиреномелії. Крім того, синдром каудальної регресії виказує свій сталий зв'язок із наявністю у матері цукриці (diabetes mellitus) [20,25,33,43,56,63], а також із багатоплідною вагітністю [2,3,8,16,34,39,47, 56,63]. Спостерігався випадок поєднання синдрому русалки з наявністю оплідних тяжів (amniotic band). Описано зв'язок із допоміжними репродуктивними технологіями, а саме із застосуванням способу ICSI (Intra$Cytoplasmic Sperm Injection), тобто, запліднення через штучне введення єдиного сперматозоїда безпосередньо до яйцеклітини [4].
Етіологія синдрому русалки остаточно невідома. Існує декілька теорій, але жодна з них не визнана достатньо переконливою [26,50–52,56,61]. Висловлюються припущення, що сиреномелія є наслідком дії тератогенних чинників, наприклад, на тваринах було одержано сиреномелію через введення до кровоносного річища кадмію [23].
Експериментально одержували ці вади шляхом опромінювання каудальної частини зародків [49], додання ретиноїдної кислоти — квасної форми вітаміна А [60], завдяки чому висловлювалось занепокоєння щодо можливого тератогенного впливу вітаміну A, вживання кокаїну [45]. Деякі автори висловлюють думку, що сиреномелія є лише клінічним проявом синдрому каудальної регресії внаслідок хибного розвитку будов каудальної мезодермальної вісі зародка до четвертого тижня вагітности,що пізніше поширюється до різних краніокаудальних рівнів [26]. Це й призводить до відсутності геніталій та агенезії нирок при залученні до хворобливих змін парамезонефральних і мезонефральних протоків.
Якщо мезонефральні протоки достатньо розвинулись, досягнувши закладених сечоводів, і з'єдналися з метанефральною бластемою, можуть бути розвиненими нирки. Іноді метанефральні ділянки мезодерми є ушкодженими або недорозвиненими, і у таких випадках утворюються гіпопластичні чи аномальні нирки [5].
Описано три патогенетичні теорії розвитку sirenomelia: 1) теорія тиску, 2) теорія первинного пошкодження розвитку каудальних сомітів, що призводить до хибного розвитку нижньої частини зародка, 3) недостатнє живлення каудальної частини тіла зародка. Для розуміння патогенезу був запропонований феномен судинного обкрадання [53]. Сиреномелія може бути спричинена аномаліями бластогенезу, які перешкоджають постачанню крові до каудальних відділів плода. Відхилена судина, що є похідною жовткової артерії, відходить від черевної аорти уражених плодів і працює в якості єдиної великої артерії пуповини (частіше правої) — судини, що повертає кров через пуповину до ложиська (placenta), тобто, при синдромі русалки пуповина має лише дві судини замість трьох. Ця судина «краде» кров у будов, що розташовані нижче від її відходження, тобто у тканин каудальної частини плода. Черевна аорта часто буває меншого поперечного розміру порівняно до цієї судини, і може не мати власного достатнього розгалуження. Внаслідок судинної недостатності та відповідного зменшеного кровопостачання до каудальної частини плода зазвичай мають місце виразні вади розвитку хребта, нирок, шлунково-кишкового та сечостатевого трактів: відсутність нирок, дисгенезія нирок, неперфорований анус, адренальна ектопія, єдина артерія пуповини [2,10,30,36,43,46,52,54,56]. Внаслідок агенезії чи дисгенезії нирок під час ультразвукового дослідження (УЗД) їх взагалі можна не побачити [13,24, 26,31,46,49,53,54,56].
Є повідомлення про спостереження мультицистозної дисплязії нирок при цій патології [24]. Сечовий міхур при сиреномелії зазвичай взагалі не визначається. Виразне маловоддя, як правило, спричинене смертельнимивадами розвитку нирок, може обмежувати можливість виявлення інших складних і небезпечних структурних аномалій. Маловоддя також є причиною гіпоплязії легенів та, відповідно, грудної клітки і сприяє утворенню доліхоцефалічної форми голівки з так званим типовим обличчям Potter'а. Аномалії нирок, значне маловоддя та відповідна гіпоплязія легенів обумовлює летальність сиреномелії. Оскільки підґрунтям утворення вад є порушене кровопостачання, може спостерігатися ціла низка сполучених аномалій, навіть за відсутності повної подібності двох однакових випадків. Крім описаних вище вад розвитку, можуть спостерігатись: черевні пухирі, хибне розташування органів черевної порожнини (situs inversus), пупкова кила, атрезія стравоходу [30,36, 43,46,51,56]; відсутність верхніх кінцівок [8]; acardia та пентада Cantrell'а [18,46,48,56,62]; вади розвитку органів нервової трубки — розколини хребта, hydrocephalia, anencephalia, cyclopia, cebocephalia, holoprosencephalia, meningomyelocele [11,27,28,36,40,44,46,47,56]. Також у медичній літературі зустрічаються повідомлення про наявність серцевих аномалій [54]. Можливі непостійні додаткові скелетні аномалії включають: відсутність крижу, відсутність нижніх поперекових відділів хребта, сегментарні аномалії дистальних відділів хребта. Описані випадки фіксованого вигляду нижніх кінцівок (при злитті лише м'яких тканин нижніх кінцівок), єдиної нижньої кінцівки (при злитті кісток), аномальної кількості нижніх кінцівок [24,49].
При злитті кісток описане єдине товсте стегно [13]. Ступні можуть бути відсутні, цілком або частково злиті, можуть мати вигляд однієї ступні, зазвичай зміненої конфігурації.
Хоча в літературі описані поодинокі випадки виживання дітей при нелетальних вісцеральних аномаліях, перш за все у випадках, коли йдеться про цілком сформовані кінцівки з їх лише шкіряним або м'яко$тканинним зростанням, поєднання вад розвитку кінцівок із аноректальними аномаліями, вадами та відповідними хворобливими станами сечовивідної системи, вадами розвитку таза та зовнішніх статевих органів мають вкрай поганий прогноз, і майже завжди призводять до смерті дитини або до дуже значної інвалідності [14,32,38,52,56]. Відповідно, в разі визначення синдрому русалки до періоду життєздатності дитини є виправданим штучне переривання вагітності.
Найкращим способом діагностики sirenomelia під час просівних досліджень вважається УЗД із використанням двовимірного (2В) та тривимірного (3В) режимів, кольорового та енергетичного допплеру, який є корисним для пошуку єдиної артерії пуповини, аномальної дистальної черевної аорти, що особливо допомагає при наявності маловоддя; також при підозрі на синдром русалки при маловодді дуже корисним може бути магнітно-резонансна томографія (МРТ) [1,13,17,22,24,25,29,40$43,49, 50,54,56,57,59]. При цьому останнім часом, внаслідок все більшого поширення поєднаних просівних досліджень у термінах вагітності 11+0–13+6 тижнів, стає зрозумілим, що визначення sirenomelia наприкінці І триместру є вигіднішим у порівнянні до ІІ триместру внаслідок достатньої кількості оплідної рідини, яка в цей час значно менше залежить від виділення сечі плодом [1,7,9,22, 37,46,48,58], з чим збігається й наша думка. Зведені стегнові кістки без їх окремих рухів під час УЗД мають викликати думку про можливість злиття нижніх кінцівок. При наявності маловоддя і двосторонньої агенезії нирок, спостереження злитих нижніх кінцівок плода є ключем до антенатальної діагностики синдрому русалки.
Крім того, тепер не існує відомих біохімічних сироваткових ознак для допологової діагностики sirenomelia. Для диференційної діагностики слід виключати синдром Potter'а, синдром Meckel'я-Gruber'а, дисплязію нирок, варіанти обструктивної уропатії, тяжкий синдром затримки внутрішньоутробного розвитку плода, що в ІІ чи в ІІІ триместрах зробити вкрай важко з причин значного маловоддя.
Покращення якості діагностичного ультразвукового устаткування, поширення знань серед лікарів про рідкісні хворобливі стани призвели до можливості ранньої діагностики синдрому русалки вже у І — на початку ІІ триместрах вагітності.

В таблиці показані всі 10 знайдених нами у світовій медичній літературі описаних випадків синдрому русалки, що були визначені в І триместрі вагітності від 10 до 13 тижнів включно (пошук здійснювався через Інтернет за допомогою пошукової системи Google латинськими та кириличними літерами; додатково задавався окремий пошук серед польсько, україно та російськомовної частин Мережі, останній додаткових результатів не дав).
Виникнення та повторення синдрому русалки є спорадичним, каріотип плодів зазвичай без особливостей. Вважається, що цей стан значно частіше спостерігається при монозиготнихдвійнях — у 150 разів частіше, ніж при одноплідних вагітностях [3,46,50,56].
Для визначення каріотипу плода в І триместрі, як правило, досліджують торочкову оболонку (chorion), але при цьому слід пам'ятати, що внаслідок можливого мозаїцизму хромосомний набір торочкової оболонки не завжди відповідає хромосомному набору плода. Натомість, крім хромосомних аберацій існує багато інших чинників, що можуть ушкоджувати розвиток зародка. При перериванні вагітності видалені тканини, отримані внаслідок інструментального втручання, часто важко розпізнати в силу їх ушкодження. Таким чином, огляд і ретельне дослідження видаленого плода І триместру в більшості випадків є неможливим. Навіть у тих випадках, коли при УЗД виявляються якісь вади розвитку, не можна бути впевненим, чи знайдені вади є окремими або є однією із складових синдрому. При термінах вагітності від 11 тижнів точність ультразвукової діагностики зростає разом із зростанням розмірів плода, але ця точність значно залежить від якості діагностичного обладнання та досвіду дослідника; та навіть у найкращих умовах в І триместрі дуже складно точно оцінити за допомогою ультразвукової діагностики наявність чи відсутність, наприклад, дизморфій обличчя чи дрібних ушкоджень кінцівок. Тому, з точки зору пошуку можливих додаткових діагностичних ознак після знайдених при попередньому УЗД хворобливих змін, достатніх для прийняття родиною рішення перервати вагітність, видається доцільним та необхідним використання черезшийкової фетоскопії із наступним цитогенетичним дослідженням [64,65].
У цій статті описується випадок ультразвукової діагностики синдрому русалки (sirenomelia, сиреномелія) у плода з незміненим каріотипом у терміні вагітності 12 тижнів. Діагноз було підтверджено фетоскопічно перед перериванням вагітності через використання черезшийкової оплідної фетоскопії з наступним цитогенетичним дослідженням хромосомного набору плода.
Матеріал та методи дослідження
Уражений плід був знайдений під час планового поєднаного просівного дослідження І триместру за методом КОДА (Клініка Одного Дня для оцінки ризику Аномалій) у 31$річної пацієнтки з вилікуваною первинною неплідністю. Жінка має звичайний хромосомний набір, каріотип її чоловіка — 46, XY, inv. 9 (p21q22) (варіант норми). Родинний анамнез жінки та її чоловіка обтяженим не був. Вагітність настала після першої ж спроби запліднення in vitro (ЗІВ) з використанням інтрацитоплазматичного введення сперматозоїдів (ICSI, intra-cytoplasmic sperm injection). Перебіг вагітності в І триместрі не мав якихось особливостей. У віці вагітності 12 тижнів 2 дні під час планового просівного обстеження І триместру за методом КОДА докладне трансабдомінальне УЗД здійснювалось на ультразвуковому сканері експертного класу за всіма вимогами FMF (Fetal Medicine Foundation, Фонд Медицини Плода), акредитованим FMF для таких досліджень лікарем.
Фетоскопія проводилась діагностичним мікрогістероскопом STORZ із зовнішнім розміром 4 мм без розширення шийкової протоки та з використанням фізіологічного розчину для розширення порожнини матки. На початку дослідження (при введенні гістероскопа в порожнину матки) швидкість введення рідини становила до 100 мл/хв. Після знаходження плодового міхура торочкова та оплідна оболонки протинались ножицями, введеними через операційний канал. Після введення гістероскопа до оплідної порожнини (amnion) швидкість протікання фізіологічного розчину уповільнювалась до 30–80 мл/хв, що дозволяло добре бачити плід та зменшувати його коливання струменем рідини.
Вагітність перервана способом інструментального вишкрібання та аспірації через розширену шийкову протоку. Видалений матеріал використано для цитогенетичного дослідження каріотипу плода.
Результати досліджень та їх обговорення
Під час УЗД як складової поєднаного просівного дослідження І триместру КОДА було знайдено наступні хворобливі ознаки: зменшений для очікуваного терміну вагітності плодовий міхур (середній розмір дорівнював 50 мм, рис. 3), значно збільшений сечовий міхур (розмірам 11х8х10 мм, рис. 4), значний двобічний гідронефроз (рис. 5), єдину артерію пуповини (енергетичний допплер вказує на єдину артерію збоку сечового міхура, рис. 6) та зрощені за всією своїй довжині ніжки плода, які нагадують риб'ячий хвіст (рис. 7). Якихось інших видимих вад розвитку чи хворобливих ознак виявити не вдалось.



Переднє-задній розмір комірцевого простору(nuchal translucency) при цьому дорівнював 1,3 мм. Також було виконано 3В УЗД з метою реконструкції побаченого при 2В УЗД знайденої вади для більшої наочності для батьків (рис. 8 а,б).
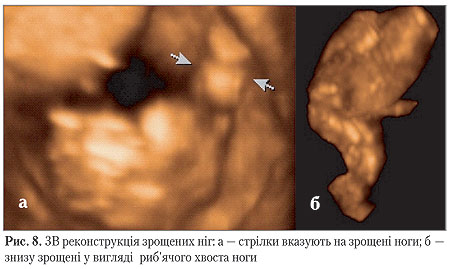
З огляду на вищевказані знайдені ознаки смертельної вади розвитку плода, родині було надано всі необхідні пояснення, після чого батьки прийняли рішення про штучне переривання вагітності. За узгодженням із родиною, перед перериванням вагітності здійснена черезшийкова фетоскопія підтвердила діагноз синдрому русалки з наявністю зрощених нижніх кінцівок (рис. 9 а,б) та єдиної артерії пуповини (рис. 10). Інших зовнішніх вад розвитку не було знайдено.

Результати цитогенетичного дослідження: mos 46,XX[67%]/~4n[33%] — мозаїчний каріотип: нормальний жіночий каріотип; білятетраплоїдний (рис. 11).

Тепер пацієнтка має вже другу вагітність терміном близько 20 тижнів, яка також отримана за допомогою ДРТ через спосіб ICSI. Планове просівне дослідження І триместру за методом КОДА було здійснено в 12 тижнів 3 дні. На підставі даних УЗД, вмісту так званих біохімічних ознак хромосомних аномалій І триместру PAPP-A (Pregnancy Associated Plasma Protein A, пов'язаний із вагітністю сироватковий білок А) та β-hCG (free β-subunit of human Chorionic Gonadotropin, вільна β під одиниця хоріонічного гонадотропіну людини), визначених в крові пацієнтки лабораторним аналізатором Kryptor німецької фірми «B.R.A.H.M.S.», а також особистих даних пацієнтки були розраховані ризики пацієнтки щодо хромосомних аномалій плода за допомогою спеціальної програми ASTRAIA, визнаної для цих розрахунків FMF. Загальні розраховані особисті ризики трисомії 21 дорівнюють 1:14945, тобто, не є підвищеними. Якихось хворобливих ультразвукових ознак під час просівного УЗД І триместру знайдено не було, тому пацієнтці надані поради звичайних планових просівних досліджень ІІ триместру із проведенням докладного УЗД у 20–21 тиждень вагітності для докладної оцінки побудови тіла плода.
Таким чином, поєднання УЗД, фетоскопії та цитогенетичного аналізу дозволило точно підтвердити початково виставлений діагноз синдрому русалки, зробити правильний висновок про популяційний ризик, оцінити так званий подальший прогноз потомства, запобігти значнішим психологічним травмам родини після діагностики сиреномелії в ІІ чи ІІІ триместрах абовже після народження дитини і допомогти батькам прийняти рішення про доцільність повторного застосування ДРТ та способу ICSI.
Висновки
1. Методологічно правильно здійснене планове просівне поєднане дослідження І триместру (від 11 тижнів 0 днів до 13 тижнів 6 днів при КТР плода від 45 мм до 84 мм) за методом КОДА дозволяє протягом 1–3 год: пояснити родині мету, сенс та зміст цього дослідження; одержати поінформовану згоду родини на дослідження; оцінити особисті ризики пацієнтки щодо ХА плода; досить докладно оцінити побудову тіла плода; надати родині всі необхідні пояснення щодо наслідків дослідження.
2. УЗД у цьому віці вагітності дозволяє вирішувати багато завдань і є достатньо інформативним навіть для діагностики такого складного рідкісного симптомокомплексу, як синдром русалки.
3. Сиреномелію легше діагностувати в першому триместрі під час просівних досліджень 11+0–13+6, ніж у ІІ триместрі, оскільки цьому ще не заважає значне маловоддя.
4. 3В УЗД не має діагностичних переваг, але іноді може бути корисним під час пояснень батькам знайдениххворобливих ознак.
5. Черезшийкова фетоскопія в поєднанні з УЗД розширює діагностичні можливості І триместру, в тому числі у випадках знайдених летальних вад розвитку плода.
ЛIТЕРАТУРА
1. First trimester diagnosis of sirenomelia: a case report and review of the literature / Akbayir O., Gungorduk K., Sudolmus S. et al. // Arch Gynecol. Obstet. — 2008, Mar. 13 (Epub ahead of print).
2. Tipe 1 Sirenomelia in one of male twins, with imperforate anus in the other male twin / Akbiyik F. et al. // Clin. Dysmorphol. — 2000, Jun. — V. 9(3). — P. 227—229.
3. Akl M.N., Saleh A.A. Sirenomelia in a monoamniotic twin: a case report // J. Reprod. Med. — 2006, Feb. — V. 51(2). — P. 138 140.
4. Bakhtar O., Benirschke K., Masliah E. Sirenomelia of an intracytoplasmic sperm injection conceptus: a case report and review of mechanism // Pediatr. Dev. Pathol. — 2006, May$Jun. — V. 9(3). — P. 245—253.
5. Barr M. Teratology (letter). — 1988. — V. 38. — P. 487—488.
6. Sirenomelia / Banerjee A. et al. // Indian. J. Pediatr. — 2003, Jul. — V. 70(7). — P. 589—591.
7. First trimester diagnosis of sirenomelia by real-time three-dimensional ultrasound: a case report / Batukan C., Ozgun M.T., Basbug M. et al. // Ultrasound Obstet. Gynecol. — 2007, Oct. — V. 30(4). — P. 647.
8. Biswas B.P., Dawn T.K., Biswas S. Combined sirenomelia and upper limb amelia in a uniovular twin // Indian. Med. Assoc. — 1985, Jul. — V. 83(7). — P. 245—246.
9. First-Trimester Diagnosis of Sirenomelia. A Case Report / Carbillon L., Seince N., Largilli re C. et al. // Fetal. Diagn. Ther. — 2001. — V. 16. — P. 284—288.
10. Sirenomelia and multicystic renal dysplasia. Apropos of 2 cases / Chappard D. et al. // J. Genet. Hum. — 1983, Dec. — V. 31, Suppl. 5. — P. 403—411.
11. Cebocephaly, alobar holoprosencephaly, spina bifida and sirenomelia in stillbirth // Chen C.P. et al. / J. Med. Genet. — 1997, Mar. — V. 34(3). — P. 252—255.
12. Sirenomelia with an uncommom osseous fusion associated with a neural tube defect / Chen C. et al. // Pediatr. Radiol. — 1998, May. — V. 28(5). — P. 293—296.
13. Chenoweth C.K., Kellogg S.J., Abu$Yousef M.M. Antenatal sonographic diagnosis of sirenomelia // J. Clin. Ultrasound. — 1991. — V. 19. — P. 167—171.
14. Long term survival of an infant with sirenomelia / Clarke L.A. et al. // Am. J. Med. Genet. — 1993, Feb. 1. — V. 45(3). — P. 292—296.
15. Caudal regression syndrome versus sirenomelia: a case report / Das B.B., Rajegowda B.K., Bainbridge R. et al. // J. Perinatol. — 2002, Mar. — V. 22(2). — P. 168—170.
16. Di Lorenzo M., Brandt M.L., Veilleux A. Sirenomelia in an identical twin: a case report // Pediatr. Surg. — 1991, Nov. — V. 26(11). — P. 1334— 13346.
17. Rare manifestations of sirenomelia syndrome: a report of five cases / Drossou-Agakidou V., Xatzisevastou$Loukidou C., Soubasi V. et al. // Am. J. Perinatol. — 2004, Oct. — V. 21(7). — P. 395—401.
18. Combined pentalogy of Cantrell and sirenomelia: a case report with especulation about a common etiology / Egan J.F. et al. // Am. J. Perinatol. — 1993, Jul. — V. 10(4). — P. 327—329.
19. Sirenomelia: urological abnormalities in a surviving mermaid / Goodman S.H. et al. // Can. J. Urol. — 1996, Sep. — V. 3(3). — P. 257—260.
20. Gurakan B., Karaasian E., Balci S. Sirenomelia in an infant of a diabetic mother. A case report // Turk. J. Pediatr. — 1996, Jul.-Sep. — V. 38(3). — P. 393—397.
21. Hadravska S., Kohoutek T. Ectopic adrenals in sirenomelic fetus // Anat Anz. — 2000, Jul. — V. 182(4). — P. 361—363.
22. Heflin D. Sirenomelia in the First Trimester // J. Diagnostic Med. Sonography. — 2007. — V. 23(6). — P. 365—367.
23. Hilbelink D.R. Kaplan: Sirenomelia: Analysis in the cadmium and lead-treated golden hamster // Teratology Carcinog. — 1986. — V. 6. — P. 431—440.
24. Antenatal diagnosis of sirenomelia (sympus apus) / Honda N., Shimokawa H., Yamaguchi Y., Satoh S., Nakano H. // J. Сlinic. Ultrasound. — 1988, Nov.-Dec. — V. 16(9). — P. 675—677.
25. Prenatal diagnosis of three caudal regresion syndromes associated with maternal diabetes / Houfflin V. et al. // Gynecol. Obstet. Biol. Reprod. (Paris). — 1996. — V. 25(4). — P. 389—395.
26. Kallen B., Winberg J. Caudal mesoderm pattern of anomalies: Transrenal agenesis to sirenomelia // Teratology. — 1973. — V. 9. — P. 99.
27. The cyclops and the mermaid: an epidemiological study of two types of rare malformation / Kallen B. et al. // J. Med. Genet. — 1992, Jan. — V. 29(1). — P. 30—35.
28. Kulkarni M.L., Sureshkumar C., Sindhur P.S. Sirenomelia with spina bifida // Indian Pediatr. — 1994, Jan. — V. 31(1). — P. 51—55.
29. Prenatal diagnosis of sirenomelia / Ladure H., D'herv D., Loget P., Poulain P. // J. Gynecol. Obstet. Biol. Reprod. (Paris). — 2006, Apr. — V. 35(2). — P. 181—185.
30. Sirenomelia and situs inversus: case report and review of the literature / Langer B. et al. // Fetal. Diagn. Ther. — 1996, Jan.-Feb. — V. 11(1). — P. 79—84.
31. Mermaid and Potter's syndrome occurring simultaneously / Liatsikos E.N. et al. // Int. Urol. Nephrol. — 1999. — V. 31(3). — P. 277—281.
32. Mermaid syndrome: virtually no hope for survival / Lutz N., Meyrat B.J., Guignard J.$P., Hohlfeld J. // Ped. Surg. International. — 2004, Jul. — V. 20(7). — P. 112—117.
33. Lynch S.A., Wright C. Sirenomelia, limb reduction defects, cardiovascular malformation, renal agenesis in an infant born to a diabetic mother // Clin. Dysmorphol. — 1997, Jan. — V. 6(1). — P. 75—80.
34. Sirenomelia dipus in a dizygotic twin / Managoli S. et al. // Indian J. Pediatr. — 2002, Dec. — V. 69(12). — P. 1093—1095.
35. Mermaid syndrome with amniotic band disruption / Managoli S. et al. // Indian J. Pediatr. — 2003, Jan. — V. 70(1). — P. 105—107.
36. A fetus with sirenomelia, omphalocele and meningomyelocele but normal kidneys / McCoy M.C. et al. // Teratology. — 1994, Aug. — V. 50(2). — P. 167—171.
37. Sirenomelia sequence: first$-rimester diagnosis with both two-and three-dimensional sonography / Monteagudo A., Mayberry P., Rebarber A. et al. // Ultrasound Med. — 2002, Aug. — V. 21(8). — P. 915—920.
38. Murphy J.J., Fraser G.C., Blair G.K. Sirenomelia: case of surviving mermaid // J. Pediatr. Surg. — 1992, Oct. — V. 27(10). — P. 1265—1268.
39. A case of sirenomelia. In one of a pair of identical twins, and in association with exomphalos / Oguz A. et al. // Turk. J. Pediatr. — 1986, Jul.— Sep. — V. 28(3). — P. 205—210.
40. Prenatal diagnosis of sirenomelia with bilateral hydrocephalus: report of previously undocumented form of VACTERL-H association / Onyeije C.I. et al. // Am. J. Perinatol. — 1998, Mar. — V. 15(3). — P. 193—197.
41. Patel S., Suchet I. The role of color and power Doppler ultrasound in the prenatal diagnosis of sirenomelia // Ultrasound Obstet. Gynecol. — 2004, Nov. — V. 24(6). — P. 684—691.
42. Single aberrant umbilical artery in a fetus with severe caudal defects: sirenomelia or caudal dysgenesis / Perez$Aytes A., Montero L., Gomez J. et al. // Am. J. Med. Genet. — 1997, Apr. 14. — V. 69(4). — P. 409—412.
43. Prenatal Diagnosis of Congenital Anomalies / R. Romero, G. Pilu, Ph. Jeanty et al. — Appleton&Lange, Norwalk, Co/San Mateo, Ca, 1988.
44. Rodriguez J.I., Palacios J., Razquin S. Sirenomelia and anencephaly // Am. J. Med. Genet. — 1991, Apr. 1. — V. 39(1). — P. 25—27.
45. Sarpong S., Headings V. Sirenomelia accompanying exposure of the embryo to cocaine // South. Med. J. — 1992, May. — V. 85(5). — P. 545—547.
46. Sirenomelia, the mermaid syndrome$detection in the first trimester / Schiesser M., Holzgreve W., Lapaire O. et al. // Prenat. Diagn. — 2003, Jun. — V. 23(6). — P. 493—495.
47. Sirenomelia and anencephaly in one of dizygotic twins / Schwalbold H. et al. // Teratology. — 1986. — V. 34. — P. 243—247.
48. Sirenomelia sequence: early prenatal diagnosis of one rare case associated with acardiac malformation / Sebasti o M., Filho Z., Guimar es Filho G.A. et al. // Arch Gynecol. Obstet. — 2007. — V. 275(4). — P. 113—118.
49. Prenatal diagnosis of sirenomelia / Sirtori M., Ghidini A., Romero R., Hobbins J.C. // J. Ultrasound Med. — 1989. — V. 8. — P. 83—88.
50. Smith D.W., Jones K.L. Recognizable patterns of human malformation. Genetic, Embryologic and Clinical Aspects. — 2nd ed. — Saunders-Philadelphia-London-Toronto, 1976. — P. 486—487.
51. Sirenomelia with oesophageal atresia / Sozubir S. et al. // Adv. Clin. Path. — 2000, Oct. — V. 4(4). — P. 165—168.
52. Stanton M.P., Penington E.C., Hutson J.M. A surviving infant with sirenomelia (Mermaid syndrome) associated with absent bladder // J. Pediatr. Surg. — 2003, Aug. — V. 38(8). — P. 1266—1268.
53. Vascular steal: the pathogenetic mechanism producing sirenomelia and associated defects of the viscera and soft tissues. Stevenson R.E., Jones K.L., Phelan M.C. et al. // Pediatrics. — 1986. — V. 78. — P. 451—457.
54. Stocker J.T., Heifetz S.A. Sirenomelia: a morphological study of 33 cases and review of the literature // Perspect. Pediatr. Pathol. — 1987. — V. 10. — P. 7.
55. Limb body$wall complex in association with sirenomelia sequence / Tang T.T. et al. // Am. J. Med. Genet. — 1991, Oct. 1. — V. 41(1). — P. 21—25.
56. Ultrasonography in Obstetrics and Gynecology / P.W. Callen (eds.). — 4th ed. — Philadelphia: W.B. Saunders Company, Pe, 2000.
57. Sirenomelia. Pathological features, antenatal ultrasonographic clues, and review of current embryogenic theories / Valenzano M. et al. // Hum. Reprod. Update. — 1999, Jan.$Feb. — V. 5(1). — P. 82—86.
58. First trimester diagnosis of sirenomelia / Van Keirsbilck J., Cannie M., Robrechts C. et al. // Prenat. Diagn. — 2006, Aug. — V. 26(8). — P. 684—688.
59. Early second$trimester diagnosis of sirenomelia / Van ZalenSrock M.M. et al. // Prenat. Diagn. — 1995, Feb. — V. 15(2). — P. 171—177.
60. A case of parcial sirenomelia and posible vitamin A teratogenesis / Von Lennep E. et al. // Prenatal Diagnosis. — 1985. — V. 5. — P. 35—40.
61. Young I.D., O'Reilly K.M., Kendall C.H. Etiological heterogeneity in sirenomelia // Pediatr. Pethol. — 1986. — V. 5(1). — P. 31—43.
62. Sirenomelia sequence: early prenatal diagnosis of one rare case associated with acardiac malformation / Zanforlin Filho S.M., Guimar es Filho H.A., Araujo J nior E., Pires C.R., Mattar R., Nardozza L.M. // Arch Gynecol. Obstet. — 2007, Apr. — V. 275(4). — P. 315—316.
63. Zaw W., Stone D.G. Caudal regression syndrome in twin pregnacy with type II diabetes // J. Perinatol. — 2002, Mar. — V. 22(2). — P. 171—174.
64. Ембріоскопія в обстеженнях пацієнток із завмерлими в І триместрі вагітностями / Судома І., Соловйов О., Маслій Ю., Гончарова Я. // Здоровье женщины. — 2007. — №3. — С. 163—167.
65. Соловйов О., Судома І. Випадок діагностики пентади Cantrell в І триместрі з фетоскопічним підтвердженням // Здоровье женщины. —
2007. — №4(32). — С. 136—143.
66. Trevisan R. Sirenomelia // The.Fetus.net. 2007—10—29—02.
Ключові слова: сиреномелія, синдром русалки, megacystis, допологова діагностика, просівні дослідження, І триместр, КОДА, фетоскопія, лікування неплідності, ДРТ, ICSI.
Ключевые слова: сиреномелия, sirenomelia, синдром русалки, мегацистис, дородовая диагностика, просеивающие исследования, первый триместр, КОДА, фетоскопия, лечение бесплодия, ВРТ, ICSI.
Key words: sirenomelia, mermaid syndrome, megacystis, prenatal diagnosis, first trimester, screening, OSCAR, fetoscopy, infertility treatment, ART, ICSI.
Реклама:
стоматология протезирование
главные новости
английский язык Оксфорд учебники для детей и взрослых
А.А.Тимофеев стоматология медицинские книги
Берегите здоровье, экономьте время и силы, выбирайте оптимальный вариант поездки:
Расписание поездов по основным станциям Украины
Расписание самолетов, авиарейсы по основным аэропортам Украины
Расписание автобусов по основным автостанциям Украины
Расписания транспорта Украина
Расписание автобусов на табло автостанций Украины
Расписание автобусов в Европу. Билеты
Женские новости. Красота и здоровье
��� ������ � �����:
��������. ����������
���������� ����� ������:
http://old.medexpert.org.ua/modules/myarticles/article_storyid_330.html
�������:
�������� �����
������� ��������
��������. ������� �������
��������. ������� �������
|








