Использование пробиотиков с целью улучшения репродуктивного здоровья женщины
����: 2009/8/12 | ������: Здоровье женщины
Д.С. Янковский, Г.С. Дымент
Научнопроизводственная компания «О.Д. Пролисок», г. Киев
Резюме. Проведені імунологічні дослідження 23 дітей віком 2–4 років із захворюваннями органів шлунково-кишкового тракту виявили, що в процесі застосування продукту для спеціального дієтичного споживання «Мультипробіотика Апібакт» з масовою часткою екстракту прополісу 1,5% відбувається підсилення неспецифічного імунітету за рахунок активації фагоцитарних реакцій, підсилення Т-клітинної ланки імунної системи, а також активація місцевих імунних реакцій в кишечнику і верхніх дихальних шляхах, про що свідчить підвищення рівня секреторного імуноглобуліну в слині та копрофільтратах.
Резюме. Проведенные иммунологические исследования 23 детей в возрасте 2–4 лет с заболеваниями органов желудочно-кишечного тракта выявили, что в процессе применения специального продукта для диетического употребления «Мультипробиотика Апибакт» с массовой долей экстракта прополиса 1,5% происходит усиление неспецифического иммунитета за счет активации фагоцитарных реакций, усиления Т-клеточного звена иммунной системы, а также активация местных иммунных реакций в кишечнике и верхних дыхательных путях, о чем свидетельствует повышение уровня секреторного иммуноглобулина в слюне и копрофильтратах.
Summary. The immunological study carried out among 23 infants between 2 and 4 y.o. with gastrointestinal diseases showed that administration of a special food product, Apibact multiprobiotic, allows for strengthening non-specific immunity status owing to activation of phagocyte reactions, enhancement of T-cell component of the immune system, as well as activation of local immune reactions in the intestines and the upper respiratory tract. The above effects are further corroborated by an increase in blood and coprofiltrate secretory immunoglobulin levels.
Введение
Одной из актуальных проблем современной медицины является увеличение числа больных с гинекологическими заболеваниями. Рост патологии женской половой системы, особенно инфекционного характера, в том числе у беременных, не только отрицательно сказывается на здоровье самих женщин, но и способствует увеличению числа больных педиатрического профиля. Несмотря на постоянное пополнение арсенала эффективных антиинфекционных медикаментозных средств, частота гинекологических заболеваний не проявляет тенденции к снижению. Одной из причин сложившейся ситуации является недостаточное внимание к эндомикроэкологическим факторам, которые могут играть ключевую роль в возникновении, поддержании или купировании симптомов патологического процесса.
Сформировавшийся в процессе эволюции специфический симбиоз человека с определенными группами микроорганизмов, заселившими нестерильные полости и кожные покровы его тела, преобразовался в ходе филогенеза в единую микроэкологическую систему, гармонично функционирующую в пользу обеих составляющих симбиоза [15, 23].
Нормальная микробиота человека, представляющая собой специфический, жизненно важный орган, выполняет чрезвычайно широкий спектр защитных, метаболических, регуляторных и других функций, достаточно подробный анализ которых приведен во многих публикациях последних лет [1, 2, 3, 14–16, 17, 19–23].
Учитывая наиболее высокую плотность микробных популяций в толстой кишке (около 60% всей микробиоты человека), большинство исследований в области микробной экологии посвящено изучению микробиоценоза гастроинтестинального тракта, установлению причин развития кишечных дисбиозов и разработке методов их коррекции. Вместе с тем, признавая ключевую роль толстокишечного биотопа в поддержании или нарушении общего микроэкологического гомеостаза организма, нельзя не учитывать значимость микробных популяций, заселяющих другие биотопы, в первую очередь, кожные покровы, ротоглотку и вагинальный отдел мочеполовой системы. Бесспорным является также существование тесной связи между функционированием локальных микробных экосистем как между собой, так и с организмом хозяина, неотъемлемой частью которого они являются. Сложные и разнообразные механизмы регуляции, которые лежат в основе этой связи, обеспечивают гармоничную деятельность общей микроэкологической системы и ее отдельных звеньев [15, 16, 23].
В организме женщины одним из важных микроэкологических локусов, играющих значительную роль в поддержании в физиологической норме репродуктивного тракта и всего организма в целом, является вагинальный биотоп, в котором обитает около 10% аутофлоры. Состав и свойства влагалищного микробиоценоза находятся в динамическом равновесии с общебиологическими особенностями данного биотопа. Они в значительной степени взаимосвязаны с анатомическим строением влагалища; гистологической структурой его слизистой оболочки; спецификой локального кровообращения, лимфотока и иннервации; биологическими и химическими характеристиками влагалищного секрета, состоянием иммунной и эндокринной систем, общей микробиоты организма, а также экзогенными воздействиями на организм женщины [5, 6, 10, 15].

Нормальный состав вагинального нормобиоценоза женщин репродуктивного возраста приведен в таблице 1. Несмотря на многовидовой микробный пейзаж влагалищной микрофлоры, основное место в нем занимают молочнокислые бактерии (до 97% от общего количества микроорганизмов). Доля всех остальных, многочисленных представителей влагалищного биоценоза в норме не превышает 3–4%.
С момента первого описания в 1892 г. А. Doderlein лактобактерий как преобладающих микробов нормального влагалищного биоценоза [1, 10], их значимость в поддержании колонизационной резистентности женского урогенитального тракта и до настоящего времени остается неоспоримой. Известно, что первыми признаками вагинальных дисбиотических расстройств является снижение концентрации анаэробной молочнокислой флоры или потеря ею биологических свойств.
Вначале предполагалось, что группу Doderlein составляют исключительно лактобациллы. Однако позже было установлено, что важными компонентами вагинальной индигенной флоры являются также бифидобактерии и пропионовокислые бактерии [5, 6, 10, 15, 18, 23]. Эти три группы сахаролитических анаэробов выполняют ключевую роль в поддержании нормального функционирования микробной экосистемы урогенитального тракта женщины. Доминирующее положение данных микроорганиз_ мов в вагинальном биотопе обусловлено их высокими эволюционно сформировавшимися адаптационными механизмами, позволяющими активно развиваться в вагинальной среде, адгезировать к эпителию, образуя с ним прочные симбиотические связи и успешно конкурировать с факультативной и транзиторной микрофлорой.
Основное место среди индигенных лактобактерий влагалища занимает род Lactobacillus. Из данного биотопа наиболее часто выделяются представители видов L. fermentum, L. acidophilus, L. casei, L. plantarum, L. brevis и L.jensenii. Во влагалище здоровой женщины обычно одновременно присутствуют несколько видов лактобацилл, что способствует расширению спектра защитных и других физиологических свойств биоценоза. Кроме того, установлено, что у здоровых женщин лактобациллы являются доминирующей микрофлорой не только влагалища, но и уретры, что предохраняет нижние отделы мочеполового тракта от колонизации уропатогенами и их восходящей транслокации [5, 6, 10, 15].
За счет способности активно размножаться в вагинальном секрете, адгезировать к эпителиоцитам, ферментировать гликоген с накоплением короткоцепочечных жирных кислот (КЦЖК), синтезировать перекись водорода, лизоцим, бактериоцины, стимулировать местный иммунитет, данная группа молочнокислых бактерий в процессе эволюции оказалась наиболее приспособленной к колонизации влагалища и активного вытеснения из него других микроорганизмов. Об этом говорит высокая концентрация лактобацилл в вагинальном секрете здоровой женщины (до 109 КОЕ/мл).
Важным симбионтом лактобацилл является еще один представитель группы Doderlein, относящийся к роду Bifidobacterium. Принадлежность этих уникальных микроорганизмов к облигатным вагинальным бактериям была установлена позже по сравнению с родом Lactobacillus.
Возможно, это обусловлено сложностью лабораторного культивирования бифидофлоры в связи с ее строгим анаэробиозом, а также меньшей концентрацией клеток во влагалищном биотопе (до 107 КОЕ/мл). Однако во время беременности и, особенно в предродовом периоде, популяционный уровень бифидобактерий во влагалищном биоценозе резко возрастает, что связано с эволюционно сформировавшейся функцией бифидофлоры матери как наиболее важного фактора защиты организма новорожденного от колонизации его потенциальными патогенами.
Наиболее часто в вагинальной экосистеме встречаются виды B. bifidum, B. infantis, B. longum, B. breve и B. adolescentis [6, 10, 14]. Бифидобактерии так же, как и лактобациллы способны сбраживать гликоген с образованием органических кислот, адгезировать к эпителию, синтезировать антимикробные метаболиты, стимулировать местный иммунитет. Установлено, что вагинальные бифидобактерии эффективно подавляют рост гарднерелл, стафилококков, эшерихий, клебсиелл, грибов и других условно-патогенных микроорганизмов [15, 16].
Помимо лактобацилл и бифидобактерий, ценным защитным компонентом вагинального микробиоценоза являются пропионовокислые бактерии, которые также следует относить к группе Doderlein. Эти грамположительные аспорогенные анаэробы активно сбраживают гликоген с образованием пропионовой и уксусной кислот, эффективно подавляющих рост потенциальных патогенов. Кроме того, пропионибактерии обладают антиоксидантными, антимутагенными, антивирусными, антиканцерогенными, иммуностимулирующими и витаминосинтезирующими свойствами [15, 18].
Таким образом, физиологическую основу индигенной защитной микрофлоры вагинального биотопа составляют гликогенсбраживающие бактерии из родов Lactobacillus, Bifidobacterium и Propionibacterium. Помимо формирования в вагинальном биотопе условий, неблагоприятных для размножения условно_патогенной флоры, эти микроорганизмы способны стимулировать иммунитет и синтезировать метаболиты, улучшающие трофику эпителия урогенитального тракта и активизирующие процессы обновления эпителиальной ткани. К числу биологически активных метаболитов индигенной флоры относятся КЦЖК, витамины, аминокислоты, полисахариды и др. Индигенные бактерии способствуют оздоровлению женской половой сферы и за счет освобождения ее от мутагенов, канцерогенов, токсинов, оксидантов и вредных ферментов.
Предположительно нормофлора влагалища принимает участие и в противовирусной защите данного биотопа.
За счет механизма молекулярной мимикрии колонизирующие эпителий индигенные бактерии могут приобретать у эпителиальных клеток рецепторы, комплементарные вирусным лигандам, в результате этого сорбировать на своей поверхности вирусные частицы и выводить их из генитального тракта [15, 23].
Помимо индигенной облигатной физиологической микрофлоры во влагалище всегда присутствуют факультативные микроорганизмы, популяционный уровень которых в норме не превышает 3–4%, хотя их видовой состав достаточно разнообразен (до 20 видов). Все эти микроорганизмы являются условно-патогенными и при снижении активности и популяционного уровня бактерий группы Doderlein, а также других факторов колонизационной резистентности женского организма могут вызывать различные заболевания (табл. 2).

Во влагалищном биотопе всегда присутствует в незначительной концентрации транзиторная (случайная) микрофлора, среди которой встречаются и патогенные виды. Однако эти микроорганизмы могут вызывать инфекционный процесс только при глубоком нарушении состава и функций вагинального микробиоценоза и значительном угнетении иммунной системы макроорганизма [15, 16, 23].
Современный уровень знаний в области микробной экологии и микробиологии позволяют заключить, что нормальное функционирование влагалищной микробной экосистемы является одним из наиболее мощных факторов, препятствующих развитию патологических изменений в женской мочеполовой сфере. Хотелось бы еще раз подчеркнуть, что вагинальный микробиоценоз не является простой совокупностью микроорганизмов, случайно поселившихся во влагалище.Эта эволюционно сформировавшаяся сложная микробная популяция преобразовалась в процессе филогенеза в специфический многофункциональный микробный орган женского организма, находящийся не только в тесной симбиотической связи со структурными компонентами влагалища и другими биотопами микроэкологической системы, но и с функциональной активностью всей мочеполовой системы, особенно, ее иммунной и эндокринной деятельностью.
Одна из наиболее важных природных функций вагинальной экосистемы заключается в формировании микроэкологического здоровья новорожденных и человеческой популяции в целом. Известно, что первыми микроорганизмами, контаминирующими плод после стерильного внутриутробного развития, является микрофлора родовых путей матери.
Ранее состояние вагинального биоценоза родильниц, в основном, рассматривалось как основной фактор, воздействующий на процесс заселения физиологической микрофлорой кишечника ребенка. Однако значимость вагинальной материнской микрофлоры для формирования здоровья ребенка намного шире. При естественном протекании родов происходит гарантированная контаминация вагинальными микроорганизмами не только желудочнокишечного тракта, но и ротовой полости, верхних дыхательных путей, кожных покровов, мочеполового тракта.
Микрофлора здоровой родильницы рационально дополняет несовершенные защитные факторы новорожденного и предупреждает колонизацию агрессивной микрофлорой не только естественных биотопов, но и стерильных органов и систем [12–14, 15].
Характерно, что формирование вагинального биоценоза начинается сразу же после рождения девочки. Уже к концу первых суток после рождения стерильное влагалище новорожденной заселяется материнской вагинальной микрофлорой. При этом наряду с индигенными бактериями из группы Doderlein обнаруживаются условно-патогенные микроорганизмы, концентрация которых зависит от состояния микробной экологии родового пути матери.
У здоровых новорожденных очень быстро во влагалищной экосистеме начинают преобладать лактобациллы и бифидобактерии. Это во многом обусловлено интранатальной передачей активных индигенных бактерий от полученных трансплацентарно и индуцирующих синтез вагинальным эпителием гликогена, который, в свою очередь стимулирует рост бактерий группы Doderlein.
Пролиферация гликогенсбраживающих бактерий, сопровождающаяся накоплением КЦЖК, приводит к снижению рН вагинального секрета до 4,4–4,6, что сдерживает размножение чувствительных к кислоте условнопатогенных микроорганизмов [1, 5, 10, 15]. То есть в неонатальном периоде развития ребенка его вагинальный биотоп по своим свойствам значительно приближен к влагалищной экосистеме здоровых взрослых женщин. Данный период продолжается в течение 3–4 недель и является естественно сформированным механизмом своеобразной защиты урогенитального тракта ребенка от колонизации его потенциальными патогенами в период наибольшей чувствительности к неблагоприятным экзомикроэкологическим факторам.
Несмотря на то, что в дальнейшем микрофлора влагалища претерпевает закономерные изменения на разных этапах жизни, микроэкологические основы репродуктивного здоровья, заложенные в период новорожденности, играют существенную роль в его поддержании на протяжении всей дальнейшей жизни женщины.
Через 3–4 недели после рождения материнские эстрогены почти полностью исчезают из организма девочки, концентрация гликогена во влагалище также снижается, в результате чего рН влагалищного секрета повышается до нейтральной и слабощелочной реакции. Общее количество микроорганизмов во влагалище значительно снижается и со второго месяца жизни до начала пубертатного периода микроорганизмы во влагалище здоровых девочек обнаруживаются лишь в незначительных концентрациях. С момента активизации функции яичников в связи с накоплением в организме девушки собственных эстрогенов, наблюдается утолщение слоя вагинального эпителия и увеличение в нем концентрации гликогена. С этого времени бактерии группы Doderlein вновь приобретают доминирующее положение и сохраняют его во время всего репродуктивного возраста здоровой женщины. Эстрогензависимый механизм регуляции микроэкологической ситуации во влагалище приводит к изменению условий существования различных групп микроорганизмов в разные фазы менструального цикла. Особенно высокий риск дисбиотических нарушений имеется во время менструации, когда влагалищный секрет защелачивается, а концентрация гликогена снижается, что отрицательно сказывается на количестве и активности индигенной флоры [10]. Наиболее благоприятные условия для поддержания высокого уровня активной индигенной флоры влагалища наблюдается во время беременности. Значительное увеличение в эпителии концентрации гликогена способствует интенсивному развитию бактерий группы Doderlein.
Особо благоприятная микроэкологическая ситуация у здоровых беременных наблюдается, начиная с III триместра беременности. При этом заметно снижается количество потенциальных патогенов и возрастает концентрация лактобацилл и бифидобактерий. Характерно, что уровень бифидофлоры повышается не только в вагинальном биотопе, но и в других микроэкосистемах (гастроинтестинальном тракте, ротовой полости, кожных покровах, особенно в области молочных желез). Микроэкологические изменения, происходящие у здоровых женщин во время беременности, являются одним из важнейших естественно сформировавшихся факторов защиты плода от перинатальных инфекций.
В послеродовом периоде, особенно первые 4–5 недель после родов, защитные свойства вагинальной микроэкосистемы минимальны. Это связано с травмированием родового канала, снижением уровня эстрогенов, уменьшением концентрации гликогена и др. Обычно в этот период на фоне снижения концентрации клеток бактерий Doderlein увеличивается уровень бактероидов, эшерихий, энтерококков и других потенциальных патогенов. Такие нарушения представляют высокий риск развития послеродовых инфекционных осложнений. У здоровых женщин послеродовые микроэкологические нарушения в генитальном тракте носят транзиторный характер и обычно восстанавливаются к 6-й неделе послеродового периода.
Стабильные изменения во влагалищном биотопе наступают в постменопаузальном возрасте. Происходящие в этом периоде возрастные гормональные и метаболические перестройки приводят к значительным морфологическим,функциональным и биохимическим изменениям в генитальном тракте. Влагалищная среда становится нейтральной или слабощелочной, снижается концентрация гликогена, создаются неблагоприятные условия для развития индигенной микрофлоры. На фоне снижения общего уровня микроорганизмов начинает доминировать условно_патогенная флора, количество которой контролируется собственными защитными механизмами организма женщины.
Таким образом, существует целый ряд эндогенных факторов, прямо или косвенно влияющих на состав вагинальной микрофлоры в организме женщины. В норме эти факторы компенсируются естественными защитными механизмами, и состав влагалищного биоценоза является относительно постоянным во время всего репродуктивного периода жизни. Однако при пониженной резистентности организма в различные, зависимые от гормональных или метаболических изменений, периоды жизни женщины возможно развитие глубоких микроэкологических расстройств генитального тракта, которые могут послужить причиной вторичных, серьезных патологических изменений.
Отрицательное влияние на состав и функции вагинальной микроэкосистемы оказывают и многие экзогенные факторы. Наиболее опасным является неадекватное применение медикаментозных средств, в частности антибактериальных, гормональных и иммунодепрессивных препаратов, цитостатиков, лучевой терапии, противозочаточных средств и устройств [5, 10, 11].
Проблема рациональной антибиотикотерапии гинекологических больных остается одним из самых сложных вопросов клинической медицины. В современных условиях этиология практически всех инфекционных заболеваний половых органов характеризуется наличием смешанной флоры. Даже в случае экзогенных урогенитальных инфекций, обусловленных конкретным патогенным микробом, к нему очень быстро присоединяется эндогенная условно-патогенная флора нижних отделов половых путей, отличающаяся большой разнообразностью. Это вызывает необходимость использования комбинации антибактериальных препаратов, активных относительно широкого спектра возбудителей анаэробных и аэробных бактериальных инфекций, а также противогрибковые и противовирусные средства [15, 19–23].
Массивная антимикробная терапия не только вызывает глубокие микроэкологические нарушения во всем организме, в том числе и в вагинальном биотопе, лишая мочеполовую систему естественной колонизационной резистентности, но и способствует формированию мультирезистентных популяций условно-патогенных микроорганизмов, а также искусственной селекции новых патогенов, которые все чаще вовлекаются в процесс развития инфекционно-воспалительных патологий [20, 21].
Особенностью антибактериальной терапии гинекологических больных является ее антианаэробная направленность, поскольку именно анаэробам приписывается наибольшее этиологическое значение в развитии большинства гнойно-воспалительных заболеваний, в том числе послеоперационных инфекционных осложнений. Однако следует учитывать, что любое гинекологическое заболевание протекает в ассоциации с вагинальным дисбиозом, а интенсивная антибактериальная терапия с прессингом на анаэробную флору значительно усложняет дисбиотические расстройства не только во влагалище, но и в других биотопах организма. За счет этого в организме происходит искусственное формирование резервуаров условно-патогенной флоры с множественной антибиотикорезистентностью [15, 23].
Особую опасность представляет пролиферация мультирезистентных представителей видов Escherichia coli и Enterococcus faecium. Эти микроорганизмы являются постоянными обитателями различных экосистем организма, в том числе и вагинального биотопа, и, кроме того, обладают способностью быстро приобретать устойчивость ко многим антибактериальным препаратам и передавать ее другим бактериям. Как эшерихии, так и энтерококки являются одним из наиболее распространенных участников развития анаэробно-аэробных микст-инфекций. Являясь факультативными аэробами, они способны эффективно стимулировать рост облигатно-анаэробных патогенов, усиливая их вирулентный потенциал [2, 3, 21, 22].
Значительную опасность в гинекологии (в связи с быстрым приобретением антибиотикорезистентности и повышением патогенного потенциала) представляют и другие аэробные представители факультативной и транзиторной флоры вагинального биоценоза, в частности бактерии родов Staphylococcus, Streptococcus (группа B), Proteus, Klebsiella, Enterobacter и др. [15, 21].
Следует отметить, что нерациональное применение антибактериальной терапии, помимо угнетения индигенной микрофлоры, вызывает целый ряд других побочных воздействий на организм женщины, некоторые из которых представляют опасность для ее жизни (табл. 3).

Таким образом, традиционная этиотропная терапия, к сожалению, не всегда учитывает тесную связь между развитием инфекционно-воспалительных заболеваний в женской репродуктивной системе и вагинальными микроэкологическими нарушениями, значительно снижающими колонизационную резистентность урогенитального тракта и способствующими формированию эндогенного источника высоковирулентных инфекционных агентов.
В лечении гинекологических больных требуется комплексный подход, нацеленный не только на снижение популяционного уровня возбудителя заболевания, но и на восстановление нарушенной микроэкологической системы, причем не только в вагинальном биотопе, но и во всех других микробных экосистемах женского организма, особенно в пищеварительном тракте, микрофлора которого наиболее тесно связана с влагалищным биоценозом.
Анатомическая особенность расположения влагалища и ануса обеспечивает высокую частоту обмена микроорганизмами между кишечником и урогенитальным трактом. Установлено, что при вагинальных дисбиозах всегда резко возрастает в урогенитальном тракте концентрация кишечных микроорганизмов, чаще всего из родов Bacteroides, Fusobacterium, Peptostreptococcus, Clostridium, Eubacterium, Veillonella, Escherichia, Enterococcus и др. При этом в кишечном и в вагинальном биотопах заметно снижается популяционный уровень индигенных сахаролитических бактерий родов Bifidobacterium,
Lactobacillus и Propionibacterium.
Интересно отметить, что даже такие микроорганизмы как Mobiluncus, Gardnerella и Mycoplasma hominis, которые ранее считались исключительно вагинально-дисбиозной флорой, достаточно часто выделяются из кишечника и не только у женщин, но также у мужчин и детей. Это еще раз подтверждает взаимосвязь дисбиотических процессов, протекающих в различных биотопах, и необходимость разработки и внедрения в клиническую практику комплексных методов лечения гинекологических больных с обязательной коррекцией микроэкологических нарушений в различных биотопах [9, 12, 13].
В последние годы в гинекологической практике все чаще начали использовать, особенно в лечении бактериальных вагинозов, пробиотики. Это препараты, содержащие живые клетки физиологичной для человека микрофлоры,способной оказывать оздоровительное воздействие на индигенные микробиоценозы. Первые варианты пробиотиков (эубиотики), появившиеся в распоряжении отечественной клинической медицины еще в 70-х годах прошлого столетия (Бифидумбактерин, Колибактерин, Лактобактерин, Бификол), предназначались для коррекции состава и свойств кишечной микрофлоры, в первую очередь, у педиатрических больных. В последние годы перечень пробиотиков и сфера их применения значительно расширились. Многие из них рекомендуются для применения в лечении не только кишечных заболеваний, но и акушерско-гинекологической патологии. Однако, несмотря на тесную взаимосвязь в женском организме между биоценозами кишечного и влагалищного биотопов, условия для жизнедеятельности микрофлоры в них значительно различаются. Поэтому далеко не каждый облигатный представитель кишечной экосистемы сможет сохранить свою жизнеспособность во влагалище, а тем более в нем функционировать и оказывать положительный эффект на организм [5, 15].
Особые опасения вызывает применение препаратов, содержащих микроорганизмы, не относящиеся к физиологической симбиотической микрофлоре человека или являющиеся представителями условно-патогенных видов. Введение таких микроорганизмов в генитальный тракт может вызывать осложнение дисбиоза за счет дополнительных нарушений в естественном равновесном соотношении между компонентами нормофлоры и вызвать развитие непредсказуемых микроэкологических осложнений в организме, что особенно опасно для беременных. Поэтому наиболее важным требованием к составу вагинальных пробиотиков является использование только тех видов микроорганизмов, которые относятся к бактериям группы Doderlein, являются наиболее физиологичными для организма женщины и не способны вызывать отрицательных побочных реакций [3, 15].
Исходя из современных данных науки, касающихся особенностей микробной экосистемы урогенитального тракта, несложно понять причины недостаточной эффективности большинства пробиотиков, используемых в гинекологии. Ограничение состава препарата одним или несколькими штаммами пробиотической флоры не позволяет сконцентрировать в нем весь биологический потенциал, свойственный многокомпонентному вагинальному нормобиоценозу. Кроме того, большая часть известных пробиотиков предназначена для коррекции кишечных дисбиозов и не обладает свойствами, которые являются наиболее значимыми для вагинальной нормофлоры, в частности для ее пролиферации во влагалищном биотопе.
Это, в первую очередь, способность активно ферментировать гликоген с образованием КЦЖК, продуцировать перекись водорода и лизоцим, синтезировать витамины и полисахариды, ингибировать рост широкого спектра потенциальных патогенов урогенитального тракта.
Следует отметить, что большинство пробиотиков на основе молочнокислых бактерий, рекомендуемых для акушерско-гинекологических целей, при их местном применении активизируют рост дрожжеподобных грибов и вызывают риск развития или осложнения вульвовагинальных микозов, получивших в последние годы широкое распространение. Это требует особой осторожности при выборе препарата для пробиотической терапии гинекологических больных, особенно в период беременности.
Вызывает сомнения и эффективность лиофилизированной формы пробиотиков. Известно, что лиофилизированная микрофлора достаточно длительно восстанавливает свою активность (8 ч и более в зависимости от условий реактивации). Очевидно, что введение суспензии лиофилизированного пробиотика во влагалище, насыщенное большим количеством активных клеток вагинальной микрофлоры и ее антимикробных метаболитов, будет сопровождаться интенсивной гибелью вводимых бактерий и резким снижением их концентрации еще до начала восстановления жизнеспособности.
К сожалению, при лечении вагинальных дисбиозов очень редко учитывается тот факт, что нарушение в любом биотопе не протекает изолированно от других микробных экосистем и, в первую очередь, сочетается с дисбиозом пищеварительного тракта, который является основным резервуаром микрофлоры организма. Поэтому интравагинальная пробиотическая терапия никогда не приводит к стойкому клиническому эффекту без параллельной коррекции состава кишечного биоценоза.
В последние годы в пробиотической терапии гинекологических больных хорошо зарекомендовал себя отечественный мультипробиотик Симбитер-2, специально созданный для коррекции вагинальной микрофлоры с учетом наиболее важных биологических активностей нормобиоценоза. Препарат содержит 24 штамма пробиотических бактерий, выделенных из различных биотопов здоровых женщин репродуктивного возраста. Основу пробиотика составляют представители родов Lactobacillus, Bifidobacterium и Propionibacterium, т. е. наиболее физиологические компоненты нормофлоры здоровой женщины. Симбитер-2 активно ферментирует гликоген с накоплением КЦЖК (преимущественно молочной, уксусной и пропионовой кислот), поддерживающих рН вагинального секрета на физиологическом уровне; ингибирует рост широкого спектра патогенных и условно-патогенных микроорганизмов; подавляет активность вредных, в том числе канцерогенных ферментов;разрушает токсические субстанции; предупреждает транслокацию живых клеток потенциальных патогенов и их метаболитов во внутреннюю среду организма; синтезирует перекись водорода, лизоцим, бактериоцины; продуцирует витамины группы В, в том числе витамин В12; синтезирует полисахариды, способствующие уплотнению защитной биопленки, пролиферации бактерий группы Doderlein и стимуляции иммунной системы; активно восстанавливает нормобиоценоз. Симбитер-2 — это «живая» форма пробиотика, которая не требует длительного времени для реактивации. В одной дозе препарата содержится (1–5)х1012 активных клеток пробиотических бактерий. Высококонцентрированная форма препарата способствует более эффективному процессу колонизации влагалищного биотопа активными бактериями группы Doderlein и элиминации из него условно-патогенной флоры. Симбитер-2 содержит пробиотические микроорганизмы, способные восстанавливать индигенную флору во всех биотопах эндомикроэкологической системы женщины. Поэтому пробиотик рационально использовать комплексно: перорально, интравагинально и ректально. Такой метод пробиотической терапии, учитывающий тесную взаимосвязь между различными локальными экосистемами, позволяет достичь стойкого восстановления микроэкологического благополучия в организме и ликвидации всех очагов агрессивной микрофлоры [5, 9, 12, 13, 15, 22, 23].
Мультикомпонентный состав, высококонцентрированная активная форма и широкий спектр биологических свойств Симбитера-2 позволяет его эффективно использовать в лечении акушерско-гинекологических больных с различными инфекционно_воспалительными заболеваниями. В частности, пробиотик успешно используется в соответствии с разработанными схемами в комплексной терапии больных с бактериальными вагинозами; микозными вульвовагинитами; инфекциями, передающимися половым путем; воспалительными заболеваниями органов малого таза (кольпитом, цервицитом, эндометритом, сальпингитом, оофоритом, миометритом, перитонитом) [5, 9, 12, 13, 15, 24].
Поскольку Симбитер-2 содержит только физиологичную микрофлору и является абсолютно безопасным для организма, рациональным являетсяего широкое применение в акушерстве. Высокая витаминосинтезирующая активность пробиотика, особенно относительно витамина В12, позволяет рекомендовать применение препарата в лечении и для профилактики анемий беременных. Он также используется в лечении пиелонефрита, хориамнионита при преждевременном разрыве плодных оболочек, в профилактике перитонита после родоразрешения путем кесарева сечения, для санации влагалища перед родами, для предупреждения послеродовых гнойно-септических осложнений, для санации молочных желез и профилактики микроэкологических нарушений у новорожденных.
Использование Симбитера-2 в лечении хирургических больных снижает риск развития послеоперационных инфекционных осложнений и ускоряет процесс реконвалесценции [5, 12, 13, 15, 23, 24].
Материал и методы исследования
Изучалась клиническая эффективность Симбитера-2 при лечении 146 пациенток с бактериальным вагинозом.

Контрольную группу составили также 146 больных. Характеристика групп обследованных представлена в таблице 4. Как видно из приведенных данных, основная и контрольная группы больных по большинству параметров имели значительное сходство.
Больные основной группы (146 человек) в течение всего периода лечения (17 суток) получали per os Симбитер-2 (по 1 дозе в сутки во время или после еды). Одновременно проводили интравагинальную терапию всех больных, которая состояла из этапов подготовки влагалища и местной пробиотикотерапии Симбитером-2. С этой целью в течение 7-ми суток проводили санацию влагалища 3%-ным раствором молочной кислоты с экспозицией 10–20 мин (50–100 см3 раствора), после чего во влагалище вводился вагинальный крем или суппозиторий антибактериального действия (далацин или клотримазол).
После проведения таким образом этиотропной терапии, направленной на снижение в урогенитальном тракте больных популяционного уровня потенциальных патогенов, в течение 10 последующих суток на ночь на тампонах вводили интравагинально Симбитер-2, предварительно разведенный в 2–3 раза теплой кипяченой водой или физиологическим раствором (1 доза в сутки).
Больным контрольной группы (146 человек) назначали традиционную местную терапию с применением антисептика и антибактериального крема или суппозитория. До и после лечения у больных обеих групп исследовался влагалищный микробиоценоз (частота выделения микроорганизмов и концентрация клеток, lg КОЕ в 1 см3 секрета).
Результаты исследований и их обсуждение
В таблице 5 показаны результаты лечения больных обеих групп.

Как видно из данных таблицы 5, его эффективность оказалась намного выше при дополнении комплексной терапии мультипробиотиком Симбитер-2. В основной группе больных наблюдалось более быстрое, по сравнению с пациентками контрольной группы, купирование клинических признаков бактериального вагиноза, улучшение общего состояния и самочувствия, что сопровождалось восстановлением состава и свойств вагинальной нормомикробиоты (табл. 6, 7).
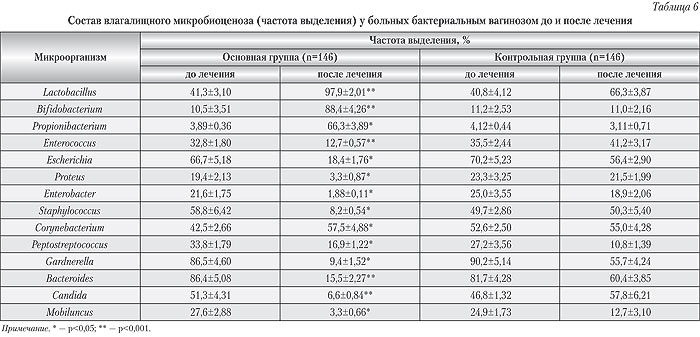

Полученные результаты подтверждают выводы многих специалистов о том, что ограничение лечения бактериальных вагинозов местным или системным применением антибактериальной терапии не устраняет основную причину заболевания, т. е. микроэкологические нарушения в биотопе, результатом чего является достаточно высокая частота рецидивов болезни и многие случаи развития микозного вульвовагинита.
При применении Симбитера-2 у 93±2,05% (р<0,05) пациенток по истечении курса лечения была восстановлена нормофлора влагалищного и толстокишечного биотопов, что позитивно отразилось на динамике купирования симптомов заболевания.Выводы
Адекватное дополнение комплексного лечения больных бактериальным вагинозом пробиотическим воздействием с помощью Симбитера-2 на нарушенную микрофлору влагалища и кишечника, являющихся наиболее важными и тесно взаимодействующими локусами микроэкологической системы женского организма, позволяет значительно повысить эффективность терапии и снизить частоту развития побочных эффектов и рецидивов болезни. В связи с наблюдающимся в последние годы резким прогрессом в расшифровке механизмов взаимодействий микробиоценозов различных экосистем с организмом человека и в понимании значимости симбиотической нормофлоры в поддержании репродуктивного здоровья, современные пробиотики на основе физиологической микрофлоры, в частности высококонцентрированный отечественный мультипробиотик Симбитер-2 с широким спектром биологических свойств, должны все шире внедряться в акушерско-гинекологическую практику.
ЛИТЕРАТУРА
1. Анкирская А.С. Бактериальный вагиноз // Акушерство и гинекология. – 1995. — №6. – С. 13–16.
2. Нарушения микробной экологии человека: причины и следствия, способы восстановления физиологической нормы / Бережной В.В., Янковский Д.С., Крамарев С.А., Шунько Е.Е., Дымент Г.С. // Здоровье женщины. – 2004. – №2(18). – С. 170–178.
3. О целесообразности использования условно-патогенных микроорганизмов в составе пробиотиков / Бережной В.В., Янковский Д.С., Крамарев С.А., Шунько Е.Е., Дымент Г.С. // Здоровье женщины. – 2004. – №3(19). – С. 191–202.
4. Характеристика вагинальной микрофлоры при внутриматочной контрацепции / Бухарин О.В., Константинова О.Д., Кремлева Е.А., Черкасов С.В. // Ж. микробиол., эпидемиол. и иммунол. – 1999. – №4. – С. 63–65.
5. Применение пробиотиков в комплексной терапии и профилактике воспалительных заболеваний в акушерстве и гинекологии: Метод. реком. / Венцковский Б.М., Товстановская В.А., Гуцуляк Р.В. и др. – К., 2001. – 28 с.
6. Микроэкологические аспекты репродуктивного здоровья женщины и современные подходы к его поддержанию / Венцковский Б.М., Товстановская В.А., Янковский Д.С., Дымент Г.С. // Здоровье женщины. – 2002. – №3 (11). – С. 86 –91.
7. Бактериальный вагиноз / Герасимович Г.И., Титов Л.П., Коршикова Р.Л., Сафина М.Р. // Укр. мед. часопис. – 1998. – №3(5). – С. 107–112.
8. Кира Е.Ф., Берлев И.В., Молчанов О.Л. Особенности течения беременности, родов и послеродового периода у женщин с дисбиотическими нарушениями влагалища // Ж. акушер. и жен. болезней. – 1999. – Т. XLVII, Вып. 2. — С. 8—11.
9. Кравченко О.В., Гуцуляк Р.В., Янковський Д.С. Застосування пробiотика «Симбiтер» в комплексному лiкуваннi бактеральних вагiнозiв // Педiатрiя, акушерство та гiнекологiя. — 2002. — №5. — С. 100—102.
10. Микроэкология влагалища. Коррекция микрофлоры при вагинальных дисбактериозах. Учебное пособие / Коршунов В.М., Володин Н.Н., Ефимов Б.А. и др. — М., 1999. — 79 с.
11. Микрофлора репродуктивного тракта женщин при внутриматочных вмешательствах / Константинова О.Д., Кремлева Е.А., Черкасов С.В., Чертков К.Л. // Ж. микробиол., эпидемиол. и иммунол. — 2000. — №2. — С. 98—100.
12. Системні порушення мікробіоценозу, їх профілактика та комплексне застосування пробіотика «Симбітер» у вагітних, годуючих матерів та дітей / Марушко Т.Л., Янковський Д.С., Отт В.Д., Тутченко Л.І., Димент Г.С., Лисяна Т.О. // Перинатологія та педіатрія. — 2004. — №4. — С. 19—26.
13. Особливості формування системи мікробіоценозу у новонароджених та немовлят та шляхи його оптимізації / Тутченко Л.И., Отт В.Д., Марушко Т.Л. и др. // Ж. практ. лікаря. — 2001. — №5. — С. 24—30.
14. Шунько Е.Е., Янковский Д.С., Дымент Г.С. Новый взгляд на формирование эндомикроэкологического статуса у новорожденных детей // Ж. практ. лiкаря. — 2003. — №1. — С. 54—61.
15. Янковский Д.С. Микробная экология человека. Современные возможности ее поддержания и восстановления: — К.: Эксперт ЛТД, 2005. — 362 с.
16. Янковский Д.С. Состав и функции микробиоценозов различных биотопов человека // Здоровье женщины. — 2003. — №4(16). — С. 145—158.
17. Настоящее и будущее пробиотиков как биокорректоров микроэкологических нарушений / Янковский Д.С., Бережной В.В., Шунько Е.Е., Крамарев С.А., Дымент Г.С. // Современная педиатрия. — 2004. — №1(2). — С. 111—118.
18. Янковский Д.С., Бережной В.В., Дымент Г.С. Переспективы использования пропионовокислых бактерий в составе пробиотиков // Современная педиатрия. — 2004. — №3(4). — С. 131—141.
19. Янковский Д.С., Дымент Г.С. Эра пробиотиков. Противоречия, проблемы, дискуссии // Коллега. — 2005. — № 3 —4.
20. Янковский Д.С., Дымент Г.С. Современные аспекты проблемы микроэкологии и дисбиозов // Здоровье женщины. — 2005. №4(24). — С. 209—218.
21. Янковский Д.С., Дымент Г.С. Проблема резистентности микрофлоры к антибиотикам и роль современных пробиотиков в ее реализации // Здоровье женщины. — 2006. — №2(26).
22. Янковский Д.С., Дымент Г.С. Пробиотики ХХI столетия. Достижения, проблемы, дискуссии / Роль пробіотиків в охороні здоров'я матері та дитини. — К., 2006. — С. 7—18.
23. Янковський Д.С. Мікробіологічна характеристика системи «організм господаря — мікробіоценози різних екологічних ніш» як основа створення мультипробіотиків нових поколінь: Автореф. дис. ... д-рабіол. наук. — Харків, 2006. — 52 с.
24. Янковский Д.С., Дымент Г.С. Микроорганизмы и здоровье человека. — К.: Эксперт ЛТД, 2008. — 552 с.
Ключові слова: діти раннього віку, гастроентерологічні захворювання, мікробіоценоз, імунітет, корекція, «Мультипробіотик Апібакт».
Ключевые слова: дети раннего возраста, гастроэнтерологические заболевания, микробиоценоз, иммунитет, коррекция, «Мультипробиотик Апибакт».
Key words: early infants, gastroenterological diseases, microbiocenosis, immunity status, correction, Apibact multiprobiotic.
Реклама:
книги купить медицина, английский
английский язык Оксфорд учебники для детей и взрослых
А.А.Тимофеев стоматология медицинские книги
Читайте также новости здоровье в главных новостях Украины, России, Европы и мира
К вашим услугам стоматология и зубное протезирование
Женские новости. Красота и здоровье
��� ������ � �����:
��������. ����������
���������� ����� ������:
http://old.medexpert.org.ua/modules/myarticles/article_storyid_326.html
�������:
�������� �����
������� ��������
��������. ������� �������
��������. ������� �������
|







