|
–‰―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ ―¹ ―Ü–Β–Μ―¨―é ―É–Μ―É―΅―à–Β–Ϋ–Η―è ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Ζ–¥–Ψ―Ä–Ψ–≤―¨―è –Ε–Β–Ϋ―â–Η–Ϋ―΄
|
 |
–î.–Γ. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι, –™.–Γ. –î―΄–Φ–Β–Ϋ―²
–ù–Α―É―΅–Ϋ–Ψ–Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤–Β–Ϋ–Ϋ–Α―è –Κ–Ψ–Φ–Ω–Α–Ϋ–Η―è ¬Ϊ–û.–î. –ü―Ä–Ψ–Μ–Η―¹–Ψ–Κ¬Μ, –≥. –ö–Η–Β–≤
–†–Β–Ζ―é–Φ–Β. –ü―Ä–Ψ–≤–Β–¥–Β–Ϋ―• ―•–Φ―É–Ϋ–Ψ–Μ–Ψ–≥―•―΅–Ϋ―• –¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ–Ϋ―è 23 –¥―•―²–Β–Ι –≤―•–Κ–Ψ–Φ 2βÄ™4 ―Ä–Ψ–Κ―•–≤ ―•–Ζ –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ–Ϋ―è–Φ–Η –Ψ―Ä–≥–Α–Ϋ―•–≤ ―à–Μ―É–Ϋ–Κ–Ψ–≤–Ψ-–Κ–Η―à–Κ–Ψ–≤–Ψ–≥–Ψ ―²―Ä–Α–Κ―²―É –≤–Η―è–≤–Η–Μ–Η, ―â–Ψ –≤ –Ω―Ä–Ψ―Ü–Β―¹―• –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è –Ω―Ä–Ψ–¥―É–Κ―²―É –¥–Μ―è ―¹–Ω–Β―Ü―•–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –¥―•―î―²–Η―΅–Ϋ–Ψ–≥–Ψ ―¹–Ω–Ψ–Ε–Η–≤–Α–Ϋ–Ϋ―è ¬Ϊ–€―É–Μ―¨―²–Η–Ω―Ä–Ψ–±―•–Ψ―²–Η–Κ–Α –ê–Ω―•–±–Α–Κ―²¬Μ –Ζ –Φ–Α―¹–Ψ–≤–Ψ―é ―΅–Α―¹―²–Κ–Ψ―é –Β–Κ―¹―²―Ä–Α–Κ―²―É –Ω―Ä–Ψ–Ω–Ψ–Μ―•―¹―É 1,5% –≤―•–¥–±―É–≤–Α―î―²―¨―¹―è –Ω―•–¥―¹–Η–Μ–Β–Ϋ–Ϋ―è –Ϋ–Β―¹–Ω–Β―Ü–Η―³―•―΅–Ϋ–Ψ–≥–Ψ ―•–Φ―É–Ϋ―•―²–Β―²―É –Ζ–Α ―Ä–Α―Ö―É–Ϋ–Ψ–Κ –Α–Κ―²–Η–≤–Α―Ü―•―½ ―³–Α–≥–Ψ―Ü–Η―²–Α―Ä–Ϋ–Η―Ö ―Ä–Β–Α–Κ―Ü―•–Ι, –Ω―•–¥―¹–Η–Μ–Β–Ϋ–Ϋ―è –Δ-–Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ―½ –Μ–Α–Ϋ–Κ–Η ―•–Φ―É–Ϋ–Ϋ–Ψ―½ ―¹–Η―¹―²–Β–Φ–Η, –Α ―²–Α–Κ–Ψ–Ε –Α–Κ―²–Η–≤–Α―Ü―•―è –Φ―•―¹―Ü–Β–≤–Η―Ö ―•–Φ―É–Ϋ–Ϋ–Η―Ö ―Ä–Β–Α–Κ―Ü―•–Ι –≤ –Κ–Η―à–Β―΅–Ϋ–Η–Κ―É ―• –≤–Β―Ä―Ö–Ϋ―•―Ö –¥–Η―Ö–Α–Μ―¨–Ϋ–Η―Ö ―à–Μ―è―Ö–Α―Ö, –Ω―Ä–Ψ ―â–Ψ ―¹–≤―•–¥―΅–Η―²―¨ –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è ―Ä―•–≤–Ϋ―è ―¹–Β–Κ―Ä–Β―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ ―•–Φ―É–Ϋ–Ψ–≥–Μ–Ψ–±―É–Μ―•–Ϋ―É –≤ ―¹–Μ–Η–Ϋ―• ―²–Α –Κ–Ψ–Ω―Ä–Ψ―³―•–Μ―¨―²―Ä–Α―²–Α―Ö.
–†–Β–Ζ―é–Φ–Β. –ü―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ϋ―΄–Β –Η–Φ–Φ―É–Ϋ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è 23 –¥–Β―²–Β–Ι –≤ –≤–Ψ–Ζ―Ä–Α―¹―²–Β 2βÄ™4 –Μ–Β―² ―¹ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –Ε–Β–Μ―É–¥–Ψ―΅–Ϋ–Ψ-–Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –≤―΄―è–≤–Η–Μ–Η, ―΅―²–Ψ –≤ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è ―¹–Ω–Β―Ü–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–¥―É–Κ―²–Α –¥–Μ―è –¥–Η–Β―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―É–Ω–Ψ―²―Ä–Β–±–Μ–Β–Ϋ–Η―è ¬Ϊ–€―É–Μ―¨―²–Η–Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Α –ê–Ω–Η–±–Α–Κ―²¬Μ ―¹ –Φ–Α―¹―¹–Ψ–≤–Ψ–Ι –¥–Ψ–Μ–Β–Ι ―ç–Κ―¹―²―Ä–Α–Κ―²–Α –Ω―Ä–Ψ–Ω–Ψ–Μ–Η―¹–Α 1,5% –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² ―É―¹–Η–Μ–Β–Ϋ–Η–Β –Ϋ–Β―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η–Φ–Φ―É–Ϋ–Η―²–Β―²–Α –Ζ–Α ―¹―΅–Β―² –Α–Κ―²–Η–≤–Α―Ü–Η–Η ―³–Α–≥–Ψ―Ü–Η―²–Α―Ä–Ϋ―΄―Ö ―Ä–Β–Α–Κ―Ü–Η–Ι, ―É―¹–Η–Μ–Β–Ϋ–Η―è –Δ-–Κ–Μ–Β―²–Ψ―΅–Ϋ–Ψ–≥–Ψ –Ζ–≤–Β–Ϋ–Α –Η–Φ–Φ―É–Ϋ–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Α ―²–Α–Κ–Ε–Β –Α–Κ―²–Η–≤–Α―Ü–Η―è –Φ–Β―¹―²–Ϋ―΄―Ö –Η–Φ–Φ―É–Ϋ–Ϋ―΄―Ö ―Ä–Β–Α–Κ―Ü–Η–Ι –≤ –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Β –Η –≤–Β―Ä―Ö–Ϋ–Η―Ö –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ―΄―Ö –Ω―É―²―è―Ö, –Ψ ―΅–Β–Φ ―¹–≤–Η–¥–Β―²–Β–Μ―¨―¹―²–≤―É–Β―² –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è ―¹–Β–Κ―Ä–Β―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ –Η–Φ–Φ―É–Ϋ–Ψ–≥–Μ–Ψ–±―É–Μ–Η–Ϋ–Α –≤ ―¹–Μ―é–Ϋ–Β –Η –Κ–Ψ–Ω―Ä–Ψ―³–Η–Μ―¨―²―Ä–Α―²–Α―Ö.
Summary. The immunological study carried out among 23 infants between 2 and 4 y.o. with gastrointestinal diseases showed that administration of a special food product, Apibact multiprobiotic, allows for strengthening non-specific immunity status owing to activation of phagocyte reactions, enhancement of T-cell component of the immune system, as well as activation of local immune reactions in the intestines and the upper respiratory tract. The above effects are further corroborated by an increase in blood and coprofiltrate secretory immunoglobulin levels.
–£–≤–Β–¥–Β–Ϋ–Η–Β
¬†¬† –û–¥–Ϋ–Ψ–Ι –Η–Ζ –Α–Κ―²―É–Α–Μ―¨–Ϋ―΄―Ö –Ω―Ä–Ψ–±–Μ–Β–Φ ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―΄ ―è–≤–Μ―è–Β―²―¹―è ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β ―΅–Η―¹–Μ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η. –†–Ψ―¹―² –Ω–Α―²–Ψ–Μ–Ψ–≥–Η–Η –Ε–Β–Ϋ―¹–Κ–Ψ–Ι –Ω–Ψ–Μ–Ψ–≤–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–≥–Ψ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Α, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β ―É –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö, –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ–Ψ ―¹–Κ–Α–Ζ―΄–≤–Α–Β―²―¹―è –Ϋ–Α –Ζ–¥–Ψ―Ä–Ψ–≤―¨–Β ―¹–Α–Φ–Η―Ö –Ε–Β–Ϋ―â–Η–Ϋ, –Ϋ–Ψ –Η ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η―é ―΅–Η―¹–Μ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ω–Β–¥–Η–Α―²―Ä–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω―Ä–Ψ―³–Η–Μ―è. –ù–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ–Ψ–Β –Ω–Ψ–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Β –Α―Ä―¹–Β–Ϋ–Α–Μ–Α ―ç―³―³–Β–Κ―²–Η–≤–Ϋ―΄―Ö –Α–Ϋ―²–Η–Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Ψ–Ζ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤, ―΅–Α―¹―²–Ψ―²–Α –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι –Ϋ–Β –Ω―Ä–Ψ―è–≤–Μ―è–Β―² ―²–Β–Ϋ–¥–Β–Ϋ―Ü–Η–Η –Κ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―é. –û–¥–Ϋ–Ψ–Ι –Η–Ζ –Ω―Ä–Η―΅–Η–Ϋ ―¹–Μ–Ψ–Ε–Η–≤―à–Β–Ι―¹―è ―¹–Η―²―É–Α―Ü–Η–Η ―è–≤–Μ―è–Β―²―¹―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ–Β –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β –Κ ―ç–Ϋ–¥–Ψ–Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ ―³–Α–Κ―²–Ψ―Ä–Α–Φ, –Κ–Ψ―²–Ψ―Ä―΄–Β –Φ–Ψ–≥―É―² –Η–≥―Ä–Α―²―¨ –Κ–Μ―é―΅–Β–≤―É―é ―Ä–Ψ–Μ―¨ –≤ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η–Η, –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η –Η–Μ–Η –Κ―É–Ω–Η―Ä–Ψ–≤–Α–Ϋ–Η–Η ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Ω–Α―²–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω―Ä–Ψ―Ü–Β―¹―¹–Α.
¬†¬†¬† –Γ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–≤―à–Η–Ι―¹―è –≤ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β ―ç–≤–Ψ–Μ―é―Ü–Η–Η ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η–Ι ―¹–Η–Φ–±–Η–Ψ–Ζ ―΅–Β–Μ–Ψ–≤–Β–Κ–Α ―¹ –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ―΄–Φ–Η –≥―Ä―É–Ω–Ω–Α–Φ–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤, –Ζ–Α―¹–Β–Μ–Η–≤―à–Η–Φ–Η –Ϋ–Β―¹―²–Β―Ä–Η–Μ―¨–Ϋ―΄–Β –Ω–Ψ–Μ–Ψ―¹―²–Η –Η –Κ–Ψ–Ε–Ϋ―΄–Β –Ω–Ψ–Κ―Ä–Ψ–≤―΄ –Β–≥–Ψ ―²–Β–Μ–Α, –Ω―Ä–Β–Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Μ―¹―è –≤ ―Ö–Ψ–¥–Β ―³–Η–Μ–Ψ–≥–Β–Ϋ–Β–Ζ–Α –≤ –Β–¥–Η–Ϋ―É―é –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ―É―é ―¹–Η―¹―²–Β–Φ―É, –≥–Α―Ä–Φ–Ψ–Ϋ–Η―΅–Ϋ–Ψ ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä―É―é―â―É―é –≤ –Ω–Ψ–Μ―¨–Ζ―É –Ψ–±–Β–Η―Ö ―¹–Ψ―¹―²–Α–≤–Μ―è―é―â–Η―Ö ―¹–Η–Φ–±–Η–Ψ–Ζ–Α [15, 23].
¬†¬†¬† –ù–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Α―è –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―²–Α ―΅–Β–Μ–Ψ–≤–Β–Κ–Α, –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è―é―â–Α―è ―¹–Ψ–±–Ψ–Ι ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η–Ι, –Ε–Η–Ζ–Ϋ–Β–Ϋ–Ϋ–Ψ –≤–Α–Ε–Ϋ―΄–Ι –Ψ―Ä–≥–Α–Ϋ, –≤―΄–Ω–Ψ–Μ–Ϋ―è–Β―² ―΅―Ä–Β–Ζ–≤―΄―΅–Α–Ι–Ϋ–Ψ ―à–Η―Ä–Ψ–Κ–Η–Ι ―¹–Ω–Β–Κ―²―Ä –Ζ–Α―â–Η―²–Ϋ―΄―Ö, –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Η―Ö, ―Ä–Β–≥―É–Μ―è―²–Ψ―Ä–Ϋ―΄―Ö –Η –¥―Ä―É–≥–Η―Ö ―³―É–Ϋ–Κ―Ü–Η–Ι, –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ –Ω–Ψ–¥―Ä–Ψ–±–Ϋ―΄–Ι –Α–Ϋ–Α–Μ–Η–Ζ –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ω―Ä–Η–≤–Β–¥–Β–Ϋ –≤–Ψ –Φ–Ϋ–Ψ–≥–Η―Ö –Ω―É–±–Μ–Η–Κ–Α―Ü–Η―è―Ö –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η―Ö –Μ–Β―² [1, 2, 3, 14βÄ™16, 17, 19βÄ™23].
¬†¬† –Θ―΅–Η―²―΄–≤–Α―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤―΄―¹–Ψ–Κ―É―é –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²―¨ –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄―Ö –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ι –≤ ―²–Ψ–Μ―¹―²–Ψ–Ι –Κ–Η―à–Κ–Β (–Ψ–Κ–Ψ–Μ–Ψ 60% –≤―¹–Β–Ι –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―²―΄ ―΅–Β–Μ–Ψ–≤–Β–Κ–Α), –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –≤ –Ψ–±–Μ–Α―¹―²–Η –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ–Μ–Ψ–≥–Η–Η –Ω–Ψ―¹–≤―è―â–Β–Ϋ–Ψ –Η–Ζ―É―΅–Β–Ϋ–Η―é –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α –≥–Α―¹―²―Ä–Ψ–Η–Ϋ―²–Β―¹―²–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α, ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―é –Ω―Ä–Η―΅–Η–Ϋ ―Ä–Α–Ζ–≤–Η―²–Η―è –Κ–Η―à–Β―΅–Ϋ―΄―Ö –¥–Η―¹–±–Η–Ψ–Ζ–Ψ–≤ –Η ―Ä–Α–Ζ―Ä–Α–±–Ψ―²–Κ–Β –Φ–Β―²–Ψ–¥–Ψ–≤ –Η―Ö –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η. –£–Φ–Β―¹―²–Β ―¹ ―²–Β–Φ, –Ω―Ä–Η–Ζ–Ϋ–Α–≤–Α―è –Κ–Μ―é―΅–Β–≤―É―é ―Ä–Ψ–Μ―¨ ―²–Ψ–Μ―¹―²–Ψ–Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α –≤ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η –Η–Μ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Η –Ψ–±―â–Β–≥–Ψ –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –≥–Ψ–Φ–Β–Ψ―¹―²–Α–Ζ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, –Ϋ–Β–Μ―¨–Ζ―è –Ϋ–Β ―É―΅–Η―²―΄–≤–Α―²―¨ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ―¹―²―¨ –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄―Ö –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ι, –Ζ–Α―¹–Β–Μ―è―é―â–Η―Ö –¥―Ä―É–≥–Η–Β –±–Η–Ψ―²–Ψ–Ω―΄, –≤ –Ω–Β―Ä–≤―É―é –Ψ―΅–Β―Ä–Β–¥―¨, –Κ–Ψ–Ε–Ϋ―΄–Β –Ω–Ψ–Κ―Ä–Ψ–≤―΄, ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ―É –Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Ι –Ψ―²–¥–Β–Μ –Φ–Ψ―΅–Β–Ω–Ψ–Μ–Ψ–≤–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄. –ë–Β―¹―¹–Ω–Ψ―Ä–Ϋ―΄–Φ ―è–≤–Μ―è–Β―²―¹―è ―²–Α–Κ–Ε–Β ―¹―É―â–Β―¹―²–≤–Ψ–≤–Α–Ϋ–Η–Β ―²–Β―¹–Ϋ–Ψ–Ι ―¹–≤―è–Ζ–Η –Φ–Β–Ε–¥―É ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β–Φ –Μ–Ψ–Κ–Α–Μ―¨–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄―Ö ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ –Κ–Α–Κ –Φ–Β–Ε–¥―É ―¹–Ψ–±–Ψ–Ι, ―²–Α–Κ –Η ―¹ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–Φ ―Ö–Ψ–Ζ―è–Η–Ϋ–Α, –Ϋ–Β–Ψ―²―ä–Β–Φ–Μ–Β–Φ–Ψ–Ι ―΅–Α―¹―²―¨―é –Κ–Ψ―²–Ψ―Ä–Ψ–≥–Ψ –Ψ–Ϋ–Η ―è–≤–Μ―è―é―²―¹―è. –Γ–Μ–Ψ–Ε–Ϋ―΄–Β –Η ―Ä–Α–Ζ–Ϋ–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ―΄–Β –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ―΄ ―Ä–Β–≥―É–Μ―è―Ü–Η–Η, –Κ–Ψ―²–Ψ―Ä―΄–Β –Μ–Β–Ε–Α―² –≤ –Ψ―¹–Ϋ–Ψ–≤–Β ―ç―²–Ψ–Ι ―¹–≤―è–Ζ–Η, –Ψ–±–Β―¹–Ω–Β―΅–Η–≤–Α―é―² –≥–Α―Ä–Φ–Ψ–Ϋ–Η―΅–Ϋ―É―é –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨ –Ψ–±―â–Β–Ι –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄ –Η –Β–Β –Ψ―²–¥–Β–Μ―¨–Ϋ―΄―Ö –Ζ–≤–Β–Ϋ―¨–Β–≤ [15, 16, 23].
¬†¬† –£ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄ –Ψ–¥–Ϋ–Η–Φ –Η–Ζ –≤–Α–Ε–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Μ–Ψ–Κ―É―¹–Ψ–≤, –Η–≥―Ä–Α―é―â–Η―Ö –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―É―é ―Ä–Ψ–Μ―¨ –≤ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η –≤ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Ϋ–Ψ―Ä–Φ–Β ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Η –≤―¹–Β–≥–Ψ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –≤ ―Ü–Β–Μ–Ψ–Φ, ―è–≤–Μ―è–Β―²―¹―è –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Ι –±–Η–Ψ―²–Ψ–Ω, –≤ –Κ–Ψ―²–Ψ―Ä–Ψ–Φ –Ψ–±–Η―²–Α–Β―² –Ψ–Κ–Ψ–Μ–Ψ 10% –Α―É―²–Ψ―³–Μ–Ψ―Ä―΄. –Γ–Ψ―¹―²–Α–≤ –Η ―¹–≤–Ψ–Ι―¹―²–≤–Α –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α –Ϋ–Α―Ö–Ψ–¥―è―²―¹―è –≤ –¥–Η–Ϋ–Α–Φ–Η―΅–Β―¹–Κ–Ψ–Φ ―Ä–Α–≤–Ϋ–Ψ–≤–Β―¹–Η–Η ―¹ –Ψ–±―â–Β–±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ–Η –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²―è–Φ–Η –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α. –û–Ϋ–Η –≤ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι ―¹―²–Β–Ω–Β–Ϋ–Η –≤–Ζ–Α–Η–Φ–Ψ―¹–≤―è–Ζ–Α–Ϋ―΄ ―¹ –Α–Ϋ–Α―²–Ψ–Φ–Η―΅–Β―¹–Κ–Η–Φ ―¹―²―Ä–Ψ–Β–Ϋ–Η–Β–Φ –≤–Μ–Α–≥–Α–Μ–Η―â–Α; –≥–Η―¹―²–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹―²―Ä―É–Κ―²―É―Ä–Ψ–Ι –Β–≥–Ψ ―¹–Μ–Η–Ζ–Η―¹―²–Ψ–Ι –Ψ–±–Ψ–Μ–Ψ―΅–Κ–Η; ―¹–Ω–Β―Ü–Η―³–Η–Κ–Ψ–Ι –Μ–Ψ–Κ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ―Ä–Ψ–≤–Ψ–Ψ–±―Ä–Α―â–Β–Ϋ–Η―è, –Μ–Η–Φ―³–Ψ―²–Ψ–Κ–Α –Η –Η–Ϋ–Ϋ–Β―Ä–≤–Α―Ü–Η–Η; –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ–Η –Η ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η–Φ–Η ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α–Φ–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ ―¹–Β–Κ―Ä–Β―²–Α, ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β–Φ –Η–Φ–Φ―É–Ϋ–Ϋ–Ψ–Ι –Η ―ç–Ϋ–¥–Ψ–Κ―Ä–Η–Ϋ–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ, –Ψ–±―â–Β–Ι –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―²―΄ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, –Α ―²–Α–Κ–Ε–Β ―ç–Κ–Ζ–Ψ–≥–Β–Ϋ–Ϋ―΄–Φ–Η –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è–Φ–Η –Ϋ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ –Ε–Β–Ϋ―â–Η–Ϋ―΄ [5, 6, 10, 15].

¬†¬†¬† –ù–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄–Ι ―¹–Ψ―¹―²–Α–≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ϋ–Ψ―Ä–Φ–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α –Ε–Β–Ϋ―â–Η–Ϋ ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Ω―Ä–Η–≤–Β–¥–Β–Ϋ –≤ ―²–Α–±–Μ–Η―Ü–Β 1. –ù–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Φ–Ϋ–Ψ–≥–Ψ–≤–Η–¥–Ψ–≤–Ψ–Ι –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄–Ι –Ω–Β–Ι–Ζ–Α–Ε –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄, –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Β –Φ–Β―¹―²–Ψ –≤ –Ϋ–Β–Φ –Ζ–Α–Ϋ–Η–Φ–Α―é―² –Φ–Ψ–Μ–Ψ―΅–Ϋ–Ψ–Κ–Η―¹–Μ―΄–Β –±–Α–Κ―²–Β―Ä–Η–Η (–¥–Ψ 97% –Ψ―² –Ψ–±―â–Β–≥–Ψ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤). –î–Ψ–Μ―è –≤―¹–Β―Ö –Ψ―¹―²–Α–Μ―¨–Ϋ―΄―Ö, –Φ–Ϋ–Ψ–≥–Ψ―΅–Η―¹–Μ–Β–Ϋ–Ϋ―΄―Ö –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ–Β–Ι –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α –≤ –Ϋ–Ψ―Ä–Φ–Β –Ϋ–Β –Ω―Ä–Β–≤―΄―à–Α–Β―² 3βÄ™4%.
¬†¬† –Γ –Φ–Ψ–Φ–Β–Ϋ―²–Α –Ω–Β―Ä–≤–Ψ–≥–Ψ –Ψ–Ω–Η―¹–Α–Ϋ–Η―è –≤ 1892 –≥. –ê. Doderlein –Μ–Α–Κ―²–Ψ–±–Α–Κ―²–Β―Ä–Η–Ι –Κ–Α–Κ –Ω―Ä–Β–Ψ–±–Μ–Α–¥–Α―é―â–Η―Ö –Φ–Η–Κ―Ä–Ψ–±–Ψ–≤ –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α [1, 10], –Η―Ö –Ζ–Ϋ–Α―΅–Η–Φ–Ψ―¹―²―¨ –≤ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Ι ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Ε–Β–Ϋ―¹–Κ–Ψ–≥–Ψ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Η –¥–Ψ –Ϋ–Α―¹―²–Ψ―è―â–Β–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η –Ψ―¹―²–Α–Β―²―¹―è –Ϋ–Β–Ψ―¹–Ω–Ψ―Ä–Η–Φ–Ψ–Ι. –‰–Ζ–≤–Β―¹―²–Ϋ–Ψ, ―΅―²–Ψ –Ω–Β―Ä–≤―΄–Φ–Η –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Α–Φ–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –¥–Η―¹–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η―Ö ―Ä–Α―¹―¹―²―Ä–Ψ–Ι―¹―²–≤ ―è–≤–Μ―è–Β―²―¹―è ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –Α–Ϋ–Α―ç―Ä–Ψ–±–Ϋ–Ψ–Ι –Φ–Ψ–Μ–Ψ―΅–Ϋ–Ψ–Κ–Η―¹–Μ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ –Η–Μ–Η –Ω–Ψ―²–Β―Ä―è –Β―é –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö ―¹–≤–Ψ–Ι―¹―²–≤.
¬†¬† –£–Ϋ–Α―΅–Α–Μ–Β –Ω―Ä–Β–¥–Ω–Ψ–Μ–Α–≥–Α–Μ–Ψ―¹―¨, ―΅―²–Ψ –≥―Ä―É–Ω–Ω―É Doderlein ―¹–Ψ―¹―²–Α–≤–Μ―è―é―² –Η―¹–Κ–Μ―é―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ―΄. –û–¥–Ϋ–Α–Κ–Ψ –Ω–Ψ–Ζ–Ε–Β –±―΄–Μ–Ψ ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ –≤–Α–Ε–Ϋ―΄–Φ–Η –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Α–Φ–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ ―è–≤–Μ―è―é―²―¹―è ―²–Α–Κ–Ε–Β –±–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Η –Η –Ω―Ä–Ψ–Ω–Η–Ψ–Ϋ–Ψ–≤–Ψ–Κ–Η―¹–Μ―΄–Β –±–Α–Κ―²–Β―Ä–Η–Η [5, 6, 10, 15, 18, 23]. –≠―²–Η ―²―Ä–Η –≥―Ä―É–Ω–Ω―΄ ―¹–Α―Ö–Α―Ä–Ψ–Μ–Η―²–Η―΅–Β―¹–Κ–Η―Ö –Α–Ϋ–Α―ç―Ä–Ψ–±–Ψ–≤ –≤―΄–Ω–Ψ–Μ–Ϋ―è―é―² –Κ–Μ―é―΅–Β–≤―É―é ―Ä–Ψ–Μ―¨ –≤ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Ε–Β–Ϋ―â–Η–Ϋ―΄. –î–Ψ–Φ–Η–Ϋ–Η―Ä―É―é―â–Β–Β –Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Η–Β –¥–Α–Ϋ–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ_ –Φ–Ψ–≤ –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ψ –Η―Ö –≤―΄―¹–Ψ–Κ–Η–Φ–Η ―ç–≤–Ψ–Μ―é―Ü–Η–Ψ–Ϋ–Ϋ–Ψ ―¹―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–≤―à–Η–Φ–Η―¹―è –Α–¥–Α–Ω―²–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄–Φ–Η –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η, –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―â–Η–Φ–Η –Α–Κ―²–Η–≤–Ϋ–Ψ ―Ä–Α–Ζ–≤–Η–≤–Α―²―¨―¹―è –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι ―¹―Ä–Β–¥–Β, –Α–¥–≥–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Κ ―ç–Ω–Η―²–Β–Μ–Η―é, –Ψ–±―Ä–Α–Ζ―É―è ―¹ –Ϋ–Η–Φ –Ω―Ä–Ψ―΅–Ϋ―΄–Β ―¹–Η–Φ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η–Β ―¹–≤―è–Ζ–Η –Η ―É―¹–Ω–Β―à–Ϋ–Ψ –Κ–Ψ–Ϋ–Κ―É―Ä–Η―Ä–Ψ–≤–Α―²―¨ ―¹ ―³–Α–Κ―É–Μ―¨―²–Α―²–Η–≤–Ϋ–Ψ–Ι –Η ―²―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Ψ–Ι.
¬†¬†¬† –û―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Β –Φ–Β―¹―²–Ψ ―¹―Ä–Β–¥–Η –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄―Ö –Μ–Α–Κ―²–Ψ–±–Α–Κ―²–Β―Ä–Η–Ι –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Ζ–Α–Ϋ–Η–Φ–Α–Β―² ―Ä–Ψ–¥ Lactobacillus. –‰–Ζ –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―΅–Α―¹―²–Ψ –≤―΄–¥–Β–Μ―è―é―²―¹―è –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ–Η –≤–Η–¥–Ψ–≤ L. fermentum, L. acidophilus, L. casei, L. plantarum, L. brevis –Η L.jensenii. –£–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β –Ζ–¥–Ψ―Ä–Ψ–≤–Ψ–Ι –Ε–Β–Ϋ―â–Η–Ϋ―΄ –Ψ–±―΄―΅–Ϋ–Ψ –Ψ–¥–Ϋ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Η―¹―É―²―¹―²–≤―É―é―² –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Ψ –≤–Η–¥–Ψ–≤ –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ, ―΅―²–Ψ ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² ―Ä–Α―¹―à–Η―Ä–Β–Ϋ–Η―é ―¹–Ω–Β–Κ―²―Ä–Α –Ζ–Α―â–Η―²–Ϋ―΄―Ö –Η –¥―Ä―É–≥–Η―Ö ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö ―¹–≤–Ψ–Ι―¹―²–≤ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ ―É –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –Ε–Β–Ϋ―â–Η–Ϋ –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ―΄ ―è–≤–Μ―è―é―²―¹―è –¥–Ψ–Φ–Η–Ϋ–Η―Ä―É―é―â–Β–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Ψ–Ι –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Α, –Ϋ–Ψ –Η ―É―Ä–Β―²―Ä―΄, ―΅―²–Ψ –Ω―Ä–Β–¥–Ψ―Ö―Ä–Α–Ϋ―è–Β―² –Ϋ–Η–Ε–Ϋ–Η–Β –Ψ―²–¥–Β–Μ―΄ –Φ–Ψ―΅–Β–Ω–Ψ–Μ–Ψ–≤–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Ψ―² –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Η ―É―Ä–Ψ–Ω–Α―²–Ψ–≥–Β–Ϋ–Α–Φ–Η –Η –Η―Ö –≤–Ψ―¹―Ö–Ψ–¥―è―â–Β–Ι ―²―Ä–Α–Ϋ―¹–Μ–Ψ–Κ–Α―Ü–Η–Η [5, 6, 10, 15].
¬†¬† –½–Α ―¹―΅–Β―² ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²–Η –Α–Κ―²–Η–≤–Ϋ–Ψ ―Ä–Α–Ζ–Φ–Ϋ–Ψ–Ε–Α―²―¨―¹―è –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ ―¹–Β–Κ―Ä–Β―²–Β, –Α–¥–≥–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Κ ―ç–Ω–Η―²–Β–Μ–Η–Ψ―Ü–Η―²–Α–Φ, ―³–Β―Ä–Φ–Β–Ϋ―²–Η―Ä–Ψ–≤–Α―²―¨ –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ ―¹ –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η–Β–Φ –Κ–Ψ―Ä–Ψ―²–Κ–Ψ―Ü–Β–Ω–Ψ―΅–Β―΅–Ϋ―΄―Ö –Ε–Η―Ä–Ϋ―΄―Ö –Κ–Η―¹–Μ–Ψ―² (–ö–Π–•–ö), ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Ω–Β―Ä–Β–Κ–Η―¹―¨ –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α, –Μ–Η–Ζ–Ψ―Ü–Η–Φ, –±–Α–Κ―²–Β―Ä–Η–Ψ―Ü–Η–Ϋ―΄, ―¹―²–Η–Φ―É–Μ–Η―Ä–Ψ–≤–Α―²―¨ –Φ–Β―¹―²–Ϋ―΄–Ι –Η–Φ–Φ―É–Ϋ–Η―²–Β―², –¥–Α–Ϋ–Ϋ–Α―è –≥―Ä―É–Ω–Ω–Α –Φ–Ψ–Μ–Ψ―΅–Ϋ–Ψ–Κ–Η―¹–Μ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Ι –≤ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β ―ç–≤–Ψ–Μ―é―Ü–Η–Η –Ψ–Κ–Α–Ζ–Α–Μ–Α―¹―¨ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –Ω―Ä–Η―¹–Ω–Ψ―¹–Ψ–±–Μ–Β–Ϋ–Ϋ–Ψ–Ι –Κ –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Η –Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –≤―΄―²–Β―¹–Ϋ–Β–Ϋ–Η―è –Η–Ζ –Ϋ–Β–≥–Ψ –¥―Ä―É–≥–Η―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤. –û–± ―ç―²–Ψ–Φ –≥–Ψ–≤–Ψ―Ä–Η―² –≤―΄―¹–Ψ–Κ–Α―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ ―¹–Β–Κ―Ä–Β―²–Β –Ζ–¥–Ψ―Ä–Ψ–≤–Ψ–Ι –Ε–Β–Ϋ―â–Η–Ϋ―΄ (–¥–Ψ 109 –ö–û–ï/–Φ–Μ).
¬†¬† –£–Α–Ε–Ϋ―΄–Φ ―¹–Η–Φ–±–Η–Ψ–Ϋ―²–Ψ–Φ –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ ―è–≤–Μ―è–Β―²―¹―è –Β―â–Β –Ψ–¥–Η–Ϋ –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ―¨ –≥―Ä―É–Ω–Ω―΄ Doderlein, –Ψ―²–Ϋ–Ψ―¹―è―â–Η–Ι―¹―è –Κ ―Ä–Ψ–¥―É Bifidobacterium. –ü―Ä–Η–Ϋ–Α–¥–Μ–Β–Ε–Ϋ–Ψ―¹―²―¨ ―ç―²–Η―Ö ―É–Ϋ–Η–Κ–Α–Μ―¨–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –Κ –Ψ–±–Μ–Η–≥–Α―²–Ϋ―΄–Φ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Φ –±–Α–Κ―²–Β―Ä–Η―è–Φ –±―΄–Μ–Α ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Α –Ω–Ψ–Ζ–Ε–Β –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ ―Ä–Ψ–¥–Ψ–Φ Lactobacillus.
¬†¬†¬† –£–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ, ―ç―²–Ψ –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ψ ―¹–Μ–Ψ–Ε–Ϋ–Ψ―¹―²―¨―é –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ –Κ―É–Μ―¨―²–Η–≤–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –±–Η―³–Η–¥–Ψ―³–Μ–Ψ―Ä―΄ –≤ ―¹–≤―è–Ζ–Η ―¹ –Β–Β ―¹―²―Ä–Ψ–≥–Η–Φ –Α–Ϋ–Α―ç―Ä–Ψ–±–Η–Ψ–Ζ–Ψ–Φ, –Α ―²–Α–Κ–Ε–Β –Φ–Β–Ϋ―¨―à–Β–Ι –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Β–Ι –Κ–Μ–Β―²–Ψ–Κ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β (–¥–Ψ 107 –ö–û–ï/–Φ–Μ). –û–¥–Ϋ–Α–Κ–Ψ –≤–Ψ –≤―Ä–Β–Φ―è –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Η, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Ω―Ä–Β–¥―Ä–Ψ–¥–Ψ–≤–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β, –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –±–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Ι –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Φ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Β ―Ä–Β–Ζ–Κ–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α–Β―², ―΅―²–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹ ―ç–≤–Ψ–Μ―é―Ü–Η–Ψ–Ϋ–Ϋ–Ψ ―¹―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–≤―à–Β–Ι―¹―è ―³―É–Ϋ–Κ―Ü–Η–Β–Ι –±–Η―³–Η–¥–Ψ―³–Μ–Ψ―Ä―΄ –Φ–Α―²–Β―Ä–Η –Κ–Α–Κ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ–Ψ–≥–Ψ ―³–Α–Κ―²–Ψ―Ä–Α –Ζ–Α―â–Η―²―΄ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ψ―² –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Η –Β–≥–Ψ –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄–Φ–Η –Ω–Α―²–Ψ–≥–Β–Ϋ–Α–Φ–Η.
¬†¬† –ù–Α–Η–±–Ψ–Μ–Β–Β ―΅–Α―¹―²–Ψ –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ–Β –≤―¹―²―Ä–Β―΅–Α―é―²―¹―è –≤–Η–¥―΄ B. bifidum, B. infantis, B. longum, B. breve –Η B. adolescentis [6, 10, 14]. –ë–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Η ―²–Α–Κ –Ε–Β, –Κ–Α–Κ –Η –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ―΄ ―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄ ―¹–±―Ä–Α–Ε–Η–≤–Α―²―¨ –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ ―¹ –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Κ–Η―¹–Μ–Ψ―², –Α–¥–≥–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Κ ―ç–Ω–Η―²–Β–Μ–Η―é, ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Α–Ϋ―²–Η–Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄–Β –Φ–Β―²–Α–±–Ψ–Μ–Η―²―΄, ―¹―²–Η–Φ―É–Μ–Η―Ä–Ψ–≤–Α―²―¨ –Φ–Β―¹―²–Ϋ―΄–Ι –Η–Φ–Φ―É–Ϋ–Η―²–Β―². –Θ―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Β –±–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Η ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ –Ω–Ψ–¥–Α–≤–Μ―è―é―² ―Ä–Ψ―¹―² –≥–Α―Ä–¥–Ϋ–Β―Ä–Β–Μ–Μ, ―¹―²–Α―³–Η–Μ–Ψ–Κ–Ψ–Κ–Κ–Ψ–≤, ―ç―à–Β―Ä–Η―Ö–Η–Ι, –Κ–Μ–Β–±―¹–Η–Β–Μ–Μ, –≥―Ä–Η–±–Ψ–≤ –Η –¥―Ä―É–≥–Η―Ö ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ [15, 16].
¬†¬† –ü–Ψ–Φ–Η–Φ–Ψ –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ –Η –±–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Ι, ―Ü–Β–Ϋ–Ϋ―΄–Φ –Ζ–Α―â–Η―²–Ϋ―΄–Φ –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–Φ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α ―è–≤–Μ―è―é―²―¹―è –Ω―Ä–Ψ–Ω–Η–Ψ–Ϋ–Ψ–≤–Ψ–Κ–Η―¹–Μ―΄–Β –±–Α–Κ―²–Β―Ä–Η–Η, –Κ–Ψ―²–Ψ―Ä―΄–Β ―²–Α–Κ–Ε–Β ―¹–Μ–Β–¥―É–Β―² –Ψ―²–Ϋ–Ψ―¹–Η―²―¨ –Κ –≥―Ä―É–Ω–Ω–Β Doderlein. –≠―²–Η –≥―Ä–Α–Φ–Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ―΄–Β –Α―¹–Ω–Ψ―Ä–Ψ–≥–Β–Ϋ–Ϋ―΄–Β –Α–Ϋ–Α―ç―Ä–Ψ–±―΄ –Α–Κ―²–Η–≤–Ϋ–Ψ ―¹–±―Ä–Α–Ε–Η–≤–Α―é―² –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ ―¹ –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ω―Ä–Ψ–Ω–Η–Ψ–Ϋ–Ψ–≤–Ψ–Ι –Η ―É–Κ―¹―É―¹–Ϋ–Ψ–Ι –Κ–Η―¹–Μ–Ψ―², ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ –Ω–Ψ–¥–Α–≤–Μ―è―é―â–Η―Ö ―Ä–Ψ―¹―² –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –Ω―Ä–Ψ–Ω–Η–Ψ–Ϋ–Η–±–Α–Κ―²–Β―Ä–Η–Η –Ψ–±–Μ–Α–¥–Α―é―² –Α–Ϋ―²–Η–Ψ–Κ―¹–Η–¥–Α–Ϋ―²–Ϋ―΄–Φ–Η, –Α–Ϋ―²–Η–Φ―É―²–Α–≥–Β–Ϋ–Ϋ―΄–Φ–Η, –Α–Ϋ―²–Η–≤–Η―Ä―É―¹–Ϋ―΄–Φ–Η, –Α–Ϋ―²–Η–Κ–Α–Ϋ―Ü–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ―΄–Φ–Η, –Η–Φ–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ–Η―Ä―É―é―â–Η–Φ–Η –Η –≤–Η―²–Α–Φ–Η–Ϋ–Ψ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä―É―é―â–Η–Φ–Η ―¹–≤–Ψ–Ι―¹―²–≤–Α–Φ–Η [15, 18].
¬†¬†¬† –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ―É―é –Ψ―¹–Ϋ–Ψ–≤―É –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι –Ζ–Α―â–Η―²–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α ―¹–Ψ―¹―²–Α–≤–Μ―è―é―² –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ―¹–±―Ä–Α–Ε–Η–≤–Α―é―â–Η–Β –±–Α–Κ―²–Β―Ä–Η–Η –Η–Ζ ―Ä–Ψ–¥–Ψ–≤ Lactobacillus, Bifidobacterium –Η Propionibacterium. –ü–Ψ–Φ–Η–Φ–Ψ ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β ―É―¹–Μ–Ψ–≤–Η–Ι, –Ϋ–Β–±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄―Ö –¥–Μ―è ―Ä–Α–Ζ–Φ–Ϋ–Ψ–Ε–Β–Ϋ–Η―è ―É―¹–Μ–Ψ–≤–Ϋ–Ψ_–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄, ―ç―²–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ ―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄ ―¹―²–Η–Φ―É–Μ–Η―Ä–Ψ–≤–Α―²―¨ –Η–Φ–Φ―É–Ϋ–Η―²–Β―² –Η ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Φ–Β―²–Α–±–Ψ–Μ–Η―²―΄, ―É–Μ―É―΅―à–Α―é―â–Η–Β ―²―Ä–Ψ―³–Η–Κ―É ―ç–Ω–Η―²–Β–Μ–Η―è ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Η –Α–Κ―²–Η–≤–Η–Ζ–Η―Ä―É―é―â–Η–Β –Ω―Ä–Ψ―Ü–Β―¹―¹―΄ –Ψ–±–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―è ―ç–Ω–Η―²–Β–Μ–Η–Α–Μ―¨–Ϋ–Ψ–Ι ―²–Κ–Α–Ϋ–Η. –ö ―΅–Η―¹–Μ―É –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η –Α–Κ―²–Η–≤–Ϋ―΄―Ö –Φ–Β―²–Α–±–Ψ–Μ–Η―²–Ψ–≤ –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ –Ψ―²–Ϋ–Ψ―¹―è―²―¹―è –ö–Π–•–ö, –≤–Η―²–Α–Φ–Η–Ϋ―΄, –Α–Φ–Η–Ϋ–Ψ–Κ–Η―¹–Μ–Ψ―²―΄, –Ω–Ψ–Μ–Η―¹–Α―Ö–Α―Ä–Η–¥―΄ –Η –¥―Ä. –‰–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄–Β –±–Α–Κ―²–Β―Ä–Η–Η ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É―é―² –Ψ–Ζ–¥–Ψ―Ä–Ψ–≤–Μ–Β–Ϋ–Η―é –Ε–Β–Ϋ―¹–Κ–Ψ–Ι –Ω–Ψ–Μ–Ψ–≤–Ψ–Ι ―¹―³–Β―Ä―΄ –Η –Ζ–Α ―¹―΅–Β―² –Ψ―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è –Β–Β –Ψ―² –Φ―É―²–Α–≥–Β–Ϋ–Ψ–≤, –Κ–Α–Ϋ―Ü–Β―Ä–Ψ–≥–Β–Ϋ–Ψ–≤, ―²–Ψ–Κ―¹–Η–Ϋ–Ψ–≤, –Ψ–Κ―¹–Η–¥–Α–Ϋ―²–Ψ–≤ –Η –≤―Ä–Β–¥–Ϋ―΄―Ö ―³–Β―Ä–Φ–Β–Ϋ―²–Ψ–≤.
¬†¬†¬† –ü―Ä–Β–¥–Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ –Ϋ–Ψ―Ä–Φ–Ψ―³–Μ–Ψ―Ä–Α –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Ω―Ä–Η–Ϋ–Η–Φ–Α–Β―² ―É―΅–Α―¹―²–Η–Β –Η –≤ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι –Ζ–Α―â–Η―²–Β –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α.
¬†¬†¬† –½–Α ―¹―΅–Β―² –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Α –Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ–Ψ–Ι –Φ–Η–Φ–Η–Κ―Ä–Η–Η –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Η―Ä―É―é―â–Η–Β ―ç–Ω–Η―²–Β–Μ–Η–Ι –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄–Β –±–Α–Κ―²–Β―Ä–Η–Η –Φ–Ψ–≥―É―² –Ω―Ä–Η–Ψ–±―Ä–Β―²–Α―²―¨ ―É ―ç–Ω–Η―²–Β–Μ–Η–Α–Μ―¨–Ϋ―΄―Ö –Κ–Μ–Β―²–Ψ–Κ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä―΄, –Κ–Ψ–Φ–Ω–Μ–Β–Φ–Β–Ϋ―²–Α―Ä–Ϋ―΄–Β –≤–Η―Ä―É―¹–Ϋ―΄–Φ –Μ–Η–≥–Α–Ϋ–¥–Α–Φ, –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Β ―ç―²–Ψ–≥–Ψ ―¹–Ψ―Ä–±–Η―Ä–Ψ–≤–Α―²―¨ –Ϋ–Α ―¹–≤–Ψ–Β–Ι –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Η –≤–Η―Ä―É―¹–Ϋ―΄–Β ―΅–Α―¹―²–Η―Ü―΄ –Η –≤―΄–≤–Ψ–¥–Η―²―¨ –Η―Ö –Η–Ζ –≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α [15, 23].
¬†¬†¬† –ü–Ψ–Φ–Η–Φ–Ψ –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι –Ψ–±–Μ–Η–≥–Α―²–Ϋ–Ψ–Ι ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β –≤―¹–Β–≥–¥–Α –Ω―Ä–Η―¹―É―²―¹―²–≤―É―é―² ―³–Α–Κ―É–Μ―¨―²–Α―²–Η–≤–Ϋ―΄–Β –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄, –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Κ–Ψ―²–Ψ―Ä―΄―Ö –≤ –Ϋ–Ψ―Ä–Φ–Β –Ϋ–Β –Ω―Ä–Β–≤―΄―à–Α–Β―² 3βÄ™4%, ―Ö–Ψ―²―è –Η―Ö –≤–Η–¥–Ψ–≤–Ψ–Ι ―¹–Ψ―¹―²–Α–≤ –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ ―Ä–Α–Ζ–Ϋ–Ψ–Ψ–±―Ä–Α–Ζ–Β–Ϋ (–¥–Ψ 20 –≤–Η–¥–Ψ–≤). –£―¹–Β ―ç―²–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ ―è–≤–Μ―è―é―²―¹―è ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄–Φ–Η –Η –Ω―Ä–Η ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Η –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Η –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–≥–Ψ ―É―Ä–Ψ–≤–Ϋ―è –±–Α–Κ―²–Β―Ä–Η–Ι –≥―Ä―É–Ω–Ω―΄ Doderlein, –Α ―²–Α–Κ–Ε–Β –¥―Ä―É–≥–Η―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Ι ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Ε–Β–Ϋ―¹–Κ–Ψ–≥–Ψ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –Φ–Ψ–≥―É―² –≤―΄–Ζ―΄–≤–Α―²―¨ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è (―²–Α–±–Μ. 2).

¬†¬† –£–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β –≤―¹–Β–≥–¥–Α –Ω―Ä–Η―¹―É―²―¹―²–≤―É–Β―² –≤ –Ϋ–Β–Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η ―²―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ–Α―è (―¹–Μ―É―΅–Α–Ι–Ϋ–Α―è) –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α, ―¹―Ä–Β–¥–Η –Κ–Ψ―²–Ψ―Ä–Ψ–Ι –≤―¹―²―Ä–Β―΅–Α―é―²―¹―è –Η –Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄–Β –≤–Η–¥―΄. –û–¥–Ϋ–Α–Κ–Ψ ―ç―²–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ –Φ–Ψ–≥―É―² –≤―΄–Ζ―΄–≤–Α―²―¨ –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄–Ι –Ω―Ä–Ψ―Ü–Β―¹―¹ ―²–Ψ–Μ―¨–Κ–Ψ –Ω―Ä–Η –≥–Μ―É–±–Ψ–Κ–Ψ–Φ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Η ―¹–Ψ―¹―²–Α–≤–Α –Η ―³―É–Ϋ–Κ―Ü–Η–Ι –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α –Η –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Φ ―É–≥–Ϋ–Β―²–Β–Ϋ–Η–Η –Η–Φ–Φ―É–Ϋ–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄ –Φ–Α–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α [15, 16, 23].
¬†¬† –Γ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Ζ–Ϋ–Α–Ϋ–Η–Ι –≤ –Ψ–±–Μ–Α―¹―²–Η –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ–Μ–Ψ–≥–Η–Η –Η –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ–Μ–Ψ–≥–Η–Η –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―² –Ζ–Α–Κ–Μ―é―΅–Η―²―¨, ―΅―²–Ψ –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–Β ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ ―è–≤–Μ―è–Β―²―¹―è –Ψ–¥–Ϋ–Η–Φ –Η–Ζ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –Φ–Ψ―â–Ϋ―΄―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤, –Ω―Ä–Β–Ω―è―²―¹―²–≤―É―é―â–Η―Ö ―Ä–Α–Ζ–≤–Η―²–Η―é –Ω–Α―²–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι –≤ –Ε–Β–Ϋ―¹–Κ–Ψ–Ι –Φ–Ψ―΅–Β–Ω–Ψ–Μ–Ψ–≤–Ψ–Ι ―¹―³–Β―Ä–Β. –Ξ–Ψ―²–Β–Μ–Ψ―¹―¨ –±―΄ –Β―â–Β ―Ä–Α–Ζ –Ω–Ψ–¥―΅–Β―Ä–Κ–Ϋ―É―²―¨, ―΅―²–Ψ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Ι –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ –Ϋ–Β ―è–≤–Μ―è–Β―²―¹―è –Ω―Ä–Ψ―¹―²–Ψ–Ι ―¹–Ψ–≤–Ψ–Κ―É–Ω–Ϋ–Ψ―¹―²―¨―é –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤, ―¹–Μ―É―΅–Α–Ι–Ϋ–Ψ –Ω–Ψ―¹–Β–Μ–Η–≤―à–Η―Ö―¹―è –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β.–≠―²–Α ―ç–≤–Ψ–Μ―é―Ü–Η–Ψ–Ϋ–Ϋ–Ψ ―¹―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–≤―à–Α―è―¹―è ―¹–Μ–Ψ–Ε–Ϋ–Α―è –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Α―è –Ω–Ψ–Ω―É–Μ―è―Ü–Η―è –Ω―Ä–Β–Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Μ–Α―¹―¨ –≤ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β ―³–Η–Μ–Ψ–≥–Β–Ϋ–Β–Ζ–Α –≤ ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η–Ι –Φ–Ϋ–Ψ–≥–Ψ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄–Ι –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄–Ι –Ψ―Ä–≥–Α–Ϋ –Ε–Β–Ϋ―¹–Κ–Ψ–≥–Ψ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, –Ϋ–Α―Ö–Ψ–¥―è―â–Η–Ι―¹―è –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –≤ ―²–Β―¹–Ϋ–Ψ–Ι ―¹–Η–Φ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–≤―è–Ζ–Η ―¹–Ψ ―¹―²―Ä―É–Κ―²―É―Ä–Ϋ―΄–Φ–Η –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Α–Φ–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Η –¥―Ä―É–≥–Η–Φ–Η –±–Η–Ψ―²–Ψ–Ω–Α–Φ–Η –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Ϋ–Ψ –Η ―¹ ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨―é –≤―¹–Β–Ι –Φ–Ψ―΅–Β–Ω–Ψ–Μ–Ψ–≤–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ, –Β–Β –Η–Φ–Φ―É–Ϋ–Ϋ–Ψ–Ι –Η ―ç–Ϋ–¥–Ψ–Κ―Ä–Η–Ϋ–Ϋ–Ψ–Ι –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨―é.
¬†¬†¬† –û–¥–Ϋ–Α –Η–Ζ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ―΄―Ö –Ω―Ä–Η―Ä–Ψ–¥–Ϋ―΄―Ö ―³―É–Ϋ–Κ―Ü–Η–Ι –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ –Ζ–Α–Κ–Μ―é―΅–Α–Β―²―¹―è –≤ ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Η –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ζ–¥–Ψ―Ä–Ψ–≤―¨―è –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄―Ö –Η ―΅–Β–Μ–Ψ–≤–Β―΅–Β―¹–Κ–Ψ–Ι –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Η –≤ ―Ü–Β–Μ–Ψ–Φ. –‰–Ζ–≤–Β―¹―²–Ϋ–Ψ, ―΅―²–Ψ –Ω–Β―Ä–≤―΄–Φ–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η, –Κ–Ψ–Ϋ―²–Α–Φ–Η–Ϋ–Η―Ä―É―é―â–Η–Φ–Η –Ω–Μ–Ψ–¥ –Ω–Ψ―¹–Μ–Β ―¹―²–Β―Ä–Η–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–Ϋ―É―²―Ä–Η―É―²―Ä–Ψ–±–Ϋ–Ψ–≥–Ψ ―Ä–Α–Ζ–≤–Η―²–Η―è, ―è–≤–Μ―è–Β―²―¹―è –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α ―Ä–Ψ–¥–Ψ–≤―΄―Ö –Ω―É―²–Β–Ι –Φ–Α―²–Β―Ä–Η.
¬†¬†¬†¬† –†–Α–Ϋ–Β–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α ―Ä–Ψ–¥–Η–Μ―¨–Ϋ–Η―Ü, –≤ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Φ, ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α–Μ–Ψ―¹―¨ –Κ–Α–Κ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Ι ―³–Α–Κ―²–Ψ―Ä, –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤―É―é―â–Η–Ι –Ϋ–Α –Ω―Ä–Ψ―Ü–Β―¹―¹ –Ζ–Α―¹–Β–Μ–Β–Ϋ–Η―è ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Ψ–Ι –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α ―Ä–Β–±–Β–Ϋ–Κ–Α. –û–¥–Ϋ–Α–Κ–Ψ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ―¹―²―¨ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Α―²–Β―Ä–Η–Ϋ―¹–Κ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –¥–Μ―è ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Ζ–¥–Ψ―Ä–Ψ–≤―¨―è ―Ä–Β–±–Β–Ϋ–Κ–Α –Ϋ–Α–Φ–Ϋ–Ψ–≥–Ψ ―à–Η―Ä–Β. –ü―Ä–Η –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Φ –Ω―Ä–Ψ―²–Β–Κ–Α–Ϋ–Η–Η ―Ä–Ψ–¥–Ψ–≤ –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –≥–Α―Ä–Α–Ϋ―²–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Α―è –Κ–Ψ–Ϋ―²–Α–Φ–Η–Ϋ–Α―Ü–Η―è –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Φ–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Ϋ–Ψ–Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α, –Ϋ–Ψ –Η ―Ä–Ψ―²–Ψ–≤–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η, –≤–Β―Ä―Ö–Ϋ–Η―Ö –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ―΄―Ö –Ω―É―²–Β–Ι, –Κ–Ψ–Ε–Ϋ―΄―Ö –Ω–Ψ–Κ―Ä–Ψ–≤–Ψ–≤, –Φ–Ψ―΅–Β–Ω–Ψ–Μ–Ψ–≤–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α.
¬†¬†¬† –€–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α –Ζ–¥–Ψ―Ä–Ψ–≤–Ψ–Ι ―Ä–Ψ–¥–Η–Μ―¨–Ϋ–Η―Ü―΄ ―Ä–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ –¥–Ψ–Ω–Ψ–Μ–Ϋ―è–Β―² –Ϋ–Β―¹–Ψ–≤–Β―Ä―à–Β–Ϋ–Ϋ―΄–Β –Ζ–Α―â–Η―²–Ϋ―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄ –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Η –Ω―Ä–Β–¥―É–Ω―Ä–Β–Ε–¥–Α–Β―² –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η―é –Α–≥―Ä–Β―¹―¹–Η–≤–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Ψ–Ι –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –±–Η–Ψ―²–Ψ–Ω–Ψ–≤, –Ϋ–Ψ –Η ―¹―²–Β―Ä–Η–Μ―¨–Ϋ―΄―Ö –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –Η ―¹–Η―¹―²–Β–Φ [12βÄ™14, 15].
¬†¬† –Ξ–Α―Ä–Α–Κ―²–Β―Ä–Ϋ–Ψ, ―΅―²–Ψ ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α –Ϋ–Α―΅–Η–Ϋ–Α–Β―²―¹―è ―¹―Ä–Α–Ζ―É –Ε–Β –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è –¥–Β–≤–Ψ―΅–Κ–Η. –Θ–Ε–Β –Κ –Κ–Ψ–Ϋ―Ü―É –Ω–Β―Ä–≤―΄―Ö ―¹―É―²–Ψ–Κ –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è ―¹―²–Β―Ä–Η–Μ―¨–Ϋ–Ψ–Β –≤–Μ–Α–≥–Α–Μ–Η―â–Β –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ–Ψ–Ι –Ζ–Α―¹–Β–Μ―è–Β―²―¹―è –Φ–Α―²–Β―Ä–Η–Ϋ―¹–Κ–Ψ–Ι –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Ψ–Ι. –ü―Ä–Η ―ç―²–Ψ–Φ –Ϋ–Α―Ä―è–¥―É ―¹ –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄–Φ–Η –±–Α–Κ―²–Β―Ä–Η―è–Φ–Η –Η–Ζ –≥―Ä―É–Ω–Ω―΄ Doderlein –Ψ–±–Ϋ–Α―Ä―É–Ε–Η–≤–Α―é―²―¹―è ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄–Β –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄, –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ζ–Α–≤–Η―¹–Η―² –Ψ―² ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ–Μ–Ψ–≥–Η–Η ―Ä–Ψ–¥–Ψ–≤–Ψ–≥–Ψ –Ω―É―²–Η –Φ–Α―²–Β―Ä–Η.
¬†¬†¬† –Θ –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄―Ö –Ψ―΅–Β–Ϋ―¨ –±―΄―¹―²―Ä–Ψ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ–Β –Ϋ–Α―΅–Η–Ϋ–Α―é―² –Ω―Ä–Β–Ψ–±–Μ–Α–¥–Α―²―¨ –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ―΄ –Η –±–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Η. –≠―²–Ψ –≤–Ψ –Φ–Ϋ–Ψ–≥–Ψ–Φ –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ψ –Η–Ϋ―²―Ä–Α–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι –Ω–Β―Ä–Β–¥–Α―΅–Β–Ι –Α–Κ―²–Η–≤–Ϋ―΄―Ö –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Ι –Ψ―² –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄―Ö ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α―Ü–Β–Ϋ―²–Α―Ä–Ϋ–Ψ –Η –Η–Ϋ–¥―É―Ü–Η―Ä―É―é―â–Η―Ö ―¹–Η–Ϋ―²–Β–Ζ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Φ ―ç–Ω–Η―²–Β–Μ–Η–Β–Φ –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α, –Κ–Ψ―²–Ψ―Ä―΄–Ι, –≤ ―¹–≤–Ψ―é –Ψ―΅–Β―Ä–Β–¥―¨ ―¹―²–Η–Φ―É–Μ–Η―Ä―É–Β―² ―Ä–Ψ―¹―² –±–Α–Κ―²–Β―Ä–Η–Ι –≥―Ä―É–Ω–Ω―΄ Doderlein.
¬†¬†¬†¬† –ü―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η―è –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ―¹–±―Ä–Α–Ε–Η–≤–Α―é―â–Η―Ö –±–Α–Κ―²–Β―Ä–Η–Ι, ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α―é―â–Α―è―¹―è –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η–Β–Φ –ö–Π–•–ö, –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―é ―Ä–ù –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―¹–Β–Κ―Ä–Β―²–Α –¥–Ψ 4,4βÄ™4,6, ―΅―²–Ψ ―¹–¥–Β―Ä–Ε–Η–≤–Α–Β―² ―Ä–Α–Ζ–Φ–Ϋ–Ψ–Ε–Β–Ϋ–Η–Β ―΅―É–≤―¹―²–≤–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Κ –Κ–Η―¹–Μ–Ψ―²–Β ―É―¹–Μ–Ψ–≤–Ϋ–Ψ–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ [1, 5, 10, 15]. –Δ–Ψ –Β―¹―²―¨ –≤ –Ϋ–Β–Ψ–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β ―Ä–Α–Ζ–≤–Η―²–Η―è ―Ä–Β–±–Β–Ϋ–Κ–Α –Β–≥–Ψ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Ι –±–Η–Ψ―²–Ψ–Ω –Ω–Ψ ―¹–≤–Ψ–Η–Φ ―¹–≤–Ψ–Ι―¹―²–≤–Α–Φ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω―Ä–Η–±–Μ–Η–Ε–Β–Ϋ –Κ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ–Β –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö –Ε–Β–Ϋ―â–Η–Ϋ. –î–Α–Ϋ–Ϋ―΄–Ι –Ω–Β―Ä–Η–Ψ–¥ –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Α–Β―²―¹―è –≤ ―²–Β―΅–Β–Ϋ–Η–Β 3βÄ™4 –Ϋ–Β–¥–Β–Μ―¨ –Η ―è–≤–Μ―è–Β―²―¹―è –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ ―¹―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Φ –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Ψ–Φ ―¹–≤–Ψ–Β–Ψ–±―Ä–Α–Ζ–Ϋ–Ψ–Ι –Ζ–Α―â–Η―²―΄ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α ―Ä–Β–±–Β–Ϋ–Κ–Α –Ψ―² –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Η –Β–≥–Ψ –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄–Φ–Η –Ω–Α―²–Ψ–≥–Β–Ϋ–Α–Φ–Η –≤ –Ω–Β―Ä–Η–Ψ–¥ –Ϋ–Α–Η–±–Ψ–Μ―¨―à–Β–Ι ―΅―É–≤―¹―²–≤–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Κ –Ϋ–Β–±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄–Φ ―ç–Κ–Ζ–Ψ–Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ ―³–Α–Κ―²–Ψ―Ä–Α–Φ.
¬†¬†¬† –ù–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α ―²–Ψ, ―΅―²–Ψ –≤ –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–Φ –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Ω―Ä–Β―²–Β―Ä–Ω–Β–≤–Α–Β―² –Ζ–Α–Κ–Ψ–Ϋ–Ψ–Φ–Β―Ä–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –Ϋ–Α ―Ä–Α–Ζ–Ϋ―΄―Ö ―ç―²–Α–Ω–Α―Ö –Ε–Η–Ζ–Ϋ–Η, –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Ψ―¹–Ϋ–Ψ–≤―΄ ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Ζ–¥–Ψ―Ä–Ψ–≤―¨―è, –Ζ–Α–Μ–Ψ–Ε–Β–Ϋ–Ϋ―΄–Β –≤ –Ω–Β―Ä–Η–Ψ–¥ –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ–Ψ―¹―²–Η, –Η–≥―Ä–Α―é―² ―¹―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ―É―é ―Ä–Ψ–Μ―¨ –≤ –Β–≥–Ψ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η –Ϋ–Α –Ω―Ä–Ψ―²―è–Ε–Β–Ϋ–Η–Η –≤―¹–Β–Ι –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–Ι –Ε–Η–Ζ–Ϋ–Η –Ε–Β–Ϋ―â–Η–Ϋ―΄.
¬†¬†¬† –ß–Β―Ä–Β–Ζ 3βÄ™4 –Ϋ–Β–¥–Β–Μ–Η –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è –Φ–Α―²–Β―Ä–Η–Ϋ―¹–Κ–Η–Β ―ç―¹―²―Ä–Ψ–≥–Β–Ϋ―΄ –Ω–Ψ―΅―²–Η –Ω–Ψ–Μ–Ϋ–Ψ―¹―²―¨―é –Η―¹―΅–Β–Ζ–Α―é―² –Η–Ζ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –¥–Β–≤–Ψ―΅–Κ–Η, –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β ―²–Α–Κ–Ε–Β ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è, –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Β ―΅–Β–≥–Ψ ―Ä–ù –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ ―¹–Β–Κ―Ä–Β―²–Α –Ω–Ψ–≤―΄―à–Α–Β―²―¹―è –¥–Ψ –Ϋ–Β–Ι―²―Ä–Α–Μ―¨–Ϋ–Ψ–Ι –Η ―¹–Μ–Α–±–Ψ―â–Β–Μ–Ψ―΅–Ϋ–Ψ–Ι ―Ä–Β–Α–Κ―Ü–Η–Η. –û–±―â–Β–Β –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è –Η ―¹–Ψ –≤―²–Ψ―Ä–Ψ–≥–Ψ –Φ–Β―¹―è―Ü–Α –Ε–Η–Ζ–Ϋ–Η –¥–Ψ –Ϋ–Α―΅–Α–Μ–Α –Ω―É–±–Β―Ä―²–Α―²–Ϋ–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –¥–Β–≤–Ψ―΅–Β–Κ –Ψ–±–Ϋ–Α―Ä―É–Ε–Η–≤–Α―é―²―¹―è –Μ–Η―à―¨ –≤ –Ϋ–Β–Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è―Ö. –Γ –Φ–Ψ–Φ–Β–Ϋ―²–Α –Α–Κ―²–Η–≤–Η–Ζ–Α―Ü–Η–Η ―³―É–Ϋ–Κ―Ü–Η–Η ―è–Η―΅–Ϋ–Η–Κ–Ψ–≤ –≤ ―¹–≤―è–Ζ–Η ―¹ –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η–Β–Φ –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –¥–Β–≤―É―à–Κ–Η ―¹–Ψ–±―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―ç―¹―²―Ä–Ψ–≥–Β–Ϋ–Ψ–≤, –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è ―É―²–Ψ–Μ―â–Β–Ϋ–Η–Β ―¹–Μ–Ψ―è –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―ç–Ω–Η―²–Β–Μ–Η―è –Η ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –≤ –Ϋ–Β–Φ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α. –Γ ―ç―²–Ψ–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η –±–Α–Κ―²–Β―Ä–Η–Η –≥―Ä―É–Ω–Ω―΄ Doderlein –≤–Ϋ–Ψ–≤―¨ –Ω―Ä–Η–Ψ–±―Ä–Β―²–Α―é―² –¥–Ψ–Φ–Η–Ϋ–Η―Ä―É―é―â–Β–Β –Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Η–Β –Η ―¹–Ψ―Ö―Ä–Α–Ϋ―è―é―² –Β–≥–Ψ –≤–Ψ –≤―Ä–Β–Φ―è –≤―¹–Β–≥–Ψ ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Ζ–¥–Ψ―Ä–Ψ–≤–Ψ–Ι –Ε–Β–Ϋ―â–Η–Ϋ―΄. –≠―¹―²―Ä–Ψ–≥–Β–Ϋ–Ζ–Α–≤–Η―¹–Η–Φ―΄–Ι –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ ―Ä–Β–≥―É–Μ―è―Ü–Η–Η –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―²―É–Α―Ü–Η–Η –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―é ―É―¹–Μ–Ψ–≤–Η–Ι ―¹―É―â–Β―¹―²–≤–Ψ–≤–Α–Ϋ–Η―è ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –≥―Ä―É–Ω–Ω –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –≤ ―Ä–Α–Ζ–Ϋ―΄–Β ―³–Α–Ζ―΄ –Φ–Β–Ϋ―¹―²―Ä―É–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―Ü–Η–Κ–Μ–Α. –û―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤―΄―¹–Ψ–Κ–Η–Ι ―Ä–Η―¹–Κ –¥–Η―¹–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η―Ö –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι –Η–Φ–Β–Β―²―¹―è –≤–Ψ –≤―Ä–Β–Φ―è –Φ–Β–Ϋ―¹―²―Ä―É–Α―Ü–Η–Η, –Κ–Ψ–≥–¥–Α –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ―΄–Ι ―¹–Β–Κ―Ä–Β―² –Ζ–Α―â–Β–Μ–Α―΅–Η–≤–Α–Β―²―¹―è, –Α –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è, ―΅―²–Ψ –Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ–Ψ ―¹–Κ–Α–Ζ―΄–≤–Α–Β―²―¹―è –Ϋ–Α –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Β –Η –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ [10]. –ù–Α–Η–±–Ψ–Μ–Β–Β –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄–Β ―É―¹–Μ–Ψ–≤–Η―è –¥–Μ―è –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η―è –≤―΄―¹–Ψ–Κ–Ψ–≥–Ψ ―É―Ä–Ψ–≤–Ϋ―è –Α–Κ―²–Η–≤–Ϋ–Ψ–Ι –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è –≤–Ψ –≤―Ä–Β–Φ―è –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η. –½–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –≤ ―ç–Ω–Η―²–Β–Μ–Η–Η –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ–Φ―É ―Ä–Α–Ζ–≤–Η―²–Η―é –±–Α–Κ―²–Β―Ä–Η–Ι –≥―Ä―É–Ω–Ω―΄ Doderlein.
¬†¬†¬† –û―¹–Ψ–±–Ψ –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ–Α―è –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Α―è ―¹–Η―²―É–Α―Ü–Η―è ―É –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è, –Ϋ–Α―΅–Η–Ϋ–Α―è ―¹ III ―²―Ä–Η–Φ–Β―¹―²―Ä–Α –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η. –ü―Ä–Η ―ç―²–Ψ–Φ –Ζ–Α–Φ–Β―²–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤ –Η –≤–Ψ–Ζ―Ä–Α―¹―²–Α–Β―² –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –Μ–Α–Κ―²–Ψ–±–Α―Ü–Η–Μ–Μ –Η –±–Η―³–Η–¥–Ψ–±–Α–Κ―²–Β―Ä–Η–Ι. –Ξ–Α―Ä–Α–Κ―²–Β―Ä–Ϋ–Ψ, ―΅―²–Ψ ―É―Ä–Ψ–≤–Β–Ϋ―¨ –±–Η―³–Η–¥–Ψ―³–Μ–Ψ―Ä―΄ –Ω–Ψ–≤―΄―à–Α–Β―²―¹―è –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β, –Ϋ–Ψ –Η –≤ –¥―Ä―É–≥–Η―Ö –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ–Α―Ö (–≥–Α―¹―²―Ä–Ψ–Η–Ϋ―²–Β―¹―²–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ ―²―Ä–Α–Κ―²–Β, ―Ä–Ψ―²–Ψ–≤–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η, –Κ–Ψ–Ε–Ϋ―΄―Ö –Ω–Ψ–Κ―Ä–Ψ–≤–Α―Ö, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Ψ–±–Μ–Α―¹―²–Η –Φ–Ψ–Μ–Ψ―΅–Ϋ―΄―Ö –Ε–Β–Μ–Β–Ζ). –€–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è, –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥―è―â–Η–Β ―É –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –Ε–Β–Ϋ―â–Η–Ϋ –≤–Ψ –≤―Ä–Β–Φ―è –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η, ―è–≤–Μ―è―é―²―¹―è –Ψ–¥–Ϋ–Η–Φ –Η–Ζ –≤–Α–Ε–Ϋ–Β–Ι―à–Η―Ö –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ ―¹―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–≤―à–Η―Ö―¹―è ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ –Ζ–Α―â–Η―²―΄ –Ω–Μ–Ψ–¥–Α –Ψ―² –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι.
¬†¬†¬† –£ –Ω–Ψ―¹–Μ–Β―Ä–Ψ–¥–Ψ–≤–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ω–Β―Ä–≤―΄–Β 4βÄ™5 –Ϋ–Β–¥–Β–Μ―¨ –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–¥–Ψ–≤, –Ζ–Α―â–Η―²–Ϋ―΄–Β ―¹–≤–Ψ–Ι―¹―²–≤–Α –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ –Φ–Η–Ϋ–Η–Φ–Α–Μ―¨–Ϋ―΄. –≠―²–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹ ―²―Ä–Α–≤–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β–Φ ―Ä–Ψ–¥–Ψ–≤–Ψ–≥–Ψ –Κ–Α–Ϋ–Α–Μ–Α, ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ ―É―Ä–Ψ–≤–Ϋ―è ―ç―¹―²―Ä–Ψ–≥–Β–Ϋ–Ψ–≤, ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β–Φ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α –Η –¥―Ä. –û–±―΄―΅–Ϋ–Ψ –≤ ―ç―²–Ψ―² –Ω–Β―Ä–Η–Ψ–¥ –Ϋ–Α ―³–Ψ–Ϋ–Β ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –Κ–Μ–Β―²–Ψ–Κ –±–Α–Κ―²–Β―Ä–Η–Ι Doderlein ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―²―¹―è ―É―Ä–Ψ–≤–Β–Ϋ―¨ –±–Α–Κ―²–Β―Ä–Ψ–Η–¥–Ψ–≤, ―ç―à–Β―Ä–Η―Ö–Η–Ι, ―ç–Ϋ―²–Β―Ä–Ψ–Κ–Ψ–Κ–Κ–Ψ–≤ –Η –¥―Ä―É–≥–Η―Ö –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤. –Δ–Α–Κ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è―é―² –≤―΄―¹–Ψ–Κ–Η–Ι ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Ω–Ψ―¹–Μ–Β―Ä–Ψ–¥–Ψ–≤―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι. –Θ –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –Ε–Β–Ϋ―â–Η–Ϋ –Ω–Ψ―¹–Μ–Β―Ä–Ψ–¥–Ψ–≤―΄–Β –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –≤ –≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–Φ ―²―Ä–Α–Κ―²–Β –Ϋ–Ψ―¹―è―² ―²―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ―΄–Ι ―Ö–Α―Ä–Α–Κ―²–Β―Ä –Η –Ψ–±―΄―΅–Ϋ–Ψ –≤–Ψ―¹―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α―é―²―¹―è –Κ 6-–Ι –Ϋ–Β–¥–Β–Μ–Β –Ω–Ψ―¹–Μ–Β―Ä–Ψ–¥–Ψ–≤–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α.
¬†¬†¬† –Γ―²–Α–±–Η–Μ―¨–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β –Ϋ–Α―¹―²―É–Ω–Α―é―² –≤ –Ω–Ψ―¹―²–Φ–Β–Ϋ–Ψ–Ω–Α―É–Ζ–Α–Μ―¨–Ϋ–Ψ–Φ –≤–Ψ–Ζ―Ä–Α―¹―²–Β. –ü―Ä–Ψ–Η―¹―Ö–Ψ–¥―è―â–Η–Β –≤ ―ç―²–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β –≤–Ψ–Ζ―Ä–Α―¹―²–Ϋ―΄–Β –≥–Ψ―Ä–Φ–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄–Β –Η –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Η–Β –Ω–Β―Ä–Β―¹―²―Ä–Ψ–Ι–Κ–Η –Ω―Ä–Η–≤–Ψ–¥―è―² –Κ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄–Φ –Φ–Ψ―Ä―³–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ,―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄–Φ –Η –±–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η–Φ –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è–Φ –≤ –≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–Φ ―²―Ä–Α–Κ―²–Β. –£–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Α―è ―¹―Ä–Β–¥–Α ―¹―²–Α–Ϋ–Ψ–≤–Η―²―¹―è –Ϋ–Β–Ι―²―Ä–Α–Μ―¨–Ϋ–Ψ–Ι –Η–Μ–Η ―¹–Μ–Α–±–Ψ―â–Β–Μ–Ψ―΅–Ϋ–Ψ–Ι, ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ–Α, ―¹–Ψ–Ζ–¥–Α―é―²―¹―è –Ϋ–Β–±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄–Β ―É―¹–Μ–Ψ–≤–Η―è –¥–Μ―è ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄. –ù–Α ―³–Ψ–Ϋ–Β ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―è –Ψ–±―â–Β–≥–Ψ ―É―Ä–Ψ–≤–Ϋ―è –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –Ϋ–Α―΅–Η–Ϋ–Α–Β―² –¥–Ψ–Φ–Η–Ϋ–Η―Ä–Ψ–≤–Α―²―¨ ―É―¹–Μ–Ψ–≤–Ϋ–Ψ_–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Α―è ―³–Μ–Ψ―Ä–Α, –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –Κ–Ψ―²–Ψ―Ä–Ψ–Ι –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É–Β―²―¹―è ―¹–Ψ–±―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ–Η –Ζ–Α―â–Η―²–Ϋ―΄–Φ–Η –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –Ε–Β–Ϋ―â–Η–Ϋ―΄.
¬†¬†¬† –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―¹―É―â–Β―¹―²–≤―É–Β―² ―Ü–Β–Μ―΄–Ι ―Ä―è–¥ ―ç–Ϋ–¥–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤, –Ω―Ä―è–Φ–Ψ –Η–Μ–Η –Κ–Ψ―¹–≤–Β–Ϋ–Ϋ–Ψ –≤–Μ–Η―è―é―â–Η―Ö –Ϋ–Α ―¹–Ψ―¹―²–Α–≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. –£ –Ϋ–Ψ―Ä–Φ–Β ―ç―²–Η ―³–Α–Κ―²–Ψ―Ä―΄ –Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Η―Ä―É―é―²―¹―è –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ–Η –Ζ–Α―â–Η―²–Ϋ―΄–Φ–Η –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η, –Η ―¹–Ψ―¹―²–Α–≤ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α ―è–≤–Μ―è–Β―²―¹―è –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ―΄–Φ –≤–Ψ –≤―Ä–Β–Φ―è –≤―¹–Β–≥–Ψ ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α –Ε–Η–Ζ–Ϋ–Η. –û–¥–Ϋ–Α–Κ–Ψ –Ω―Ä–Η –Ω–Ψ–Ϋ–Η–Ε–Β–Ϋ–Ϋ–Ψ–Ι ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –≤ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β, –Ζ–Α–≤–Η―¹–Η–Φ―΄–Β –Ψ―² –≥–Ψ―Ä–Φ–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –Η–Μ–Η –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Η―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι, –Ω–Β―Ä–Η–Ψ–¥―΄ –Ε–Η–Ζ–Ϋ–Η –Ε–Β–Ϋ―â–Η–Ϋ―΄ –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ ―Ä–Α–Ζ–≤–Η―²–Η–Β –≥–Μ―É–±–Ψ–Κ–Η―Ö –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö ―Ä–Α―¹―¹―²―Ä–Ψ–Ι―¹―²–≤ –≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α, –Κ–Ψ―²–Ψ―Ä―΄–Β –Φ–Ψ–≥―É―² –Ω–Ψ―¹–Μ―É–Ε–Η―²―¨ –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι –≤―²–Ψ―Ä–Η―΅–Ϋ―΄―Ö, ―¹–Β―Ä―¨–Β–Ζ–Ϋ―΄―Ö –Ω–Α―²–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι.
¬†¬†¬† –û―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ–Ψ–Β –≤–Μ–Η―è–Ϋ–Η–Β –Ϋ–Α ―¹–Ψ―¹―²–Α–≤ –Η ―³―É–Ϋ–Κ―Ü–Η–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ –Ψ–Κ–Α–Ζ―΄–≤–Α―é―² –Η –Φ–Ϋ–Ψ–≥–Η–Β ―ç–Κ–Ζ–Ψ–≥–Β–Ϋ–Ϋ―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄. –ù–Α–Η–±–Ψ–Μ–Β–Β –Ψ–Ω–Α―¹–Ϋ―΄–Φ ―è–≤–Μ―è–Β―²―¹―è –Ϋ–Β–Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Ψ–Ζ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤, –≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö, –≥–Ψ―Ä–Φ–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –Η –Η–Φ–Φ―É–Ϋ–Ψ–¥–Β–Ω―Ä–Β―¹―¹–Η–≤–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, ―Ü–Η―²–Ψ―¹―²–Α―²–Η–Κ–Ψ–≤, –Μ―É―΅–Β–≤–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η, –Ω―Ä–Ψ―²–Η–≤–Ψ–Ζ–Ψ―΅–Α―²–Ψ―΅–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ –Η ―É―¹―²―Ä–Ψ–Ι―¹―²–≤ [5, 10, 11].
¬†¬†¬† –ü―Ä–Ψ–±–Μ–Β–Φ–Α ―Ä–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Α–Ϋ―²–Η–±–Η–Ψ―²–Η–Κ–Ψ―²–Β―Ä–Α–Ω–Η–Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ψ―¹―²–Α–Β―²―¹―è –Ψ–¥–Ϋ–Η–Φ –Η–Ζ ―¹–Α–Φ―΄―Ö ―¹–Μ–Ψ–Ε–Ϋ―΄―Ö –≤–Ψ–Ω―Ä–Ψ―¹–Ψ–≤ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―΄. –£ ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö ―ç―²–Η–Ψ–Μ–Ψ–≥–Η―è –Ω―Ä–Α–Κ―²–Η―΅–Β―¹–Κ–Η –≤―¹–Β―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι –Ω–Ψ–Μ–Ψ–≤―΄―Ö –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É–Β―²―¹―è –Ϋ–Α–Μ–Η―΅–Η–Β–Φ ―¹–Φ–Β―à–Α–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄. –î–Α–Ε–Β –≤ ―¹–Μ―É―΅–Α–Β ―ç–Κ–Ζ–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι, –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ϋ―΄―Ö –Κ–Ψ–Ϋ–Κ―Ä–Β―²–Ϋ―΄–Φ –Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄–Φ –Φ–Η–Κ―Ä–Ψ–±–Ψ–Φ, –Κ –Ϋ–Β–Φ―É –Ψ―΅–Β–Ϋ―¨ –±―΄―¹―²―Ä–Ψ –Ω―Ä–Η―¹–Ψ–Β–¥–Η–Ϋ―è–Β―²―¹―è ―ç–Ϋ–¥–Ψ–≥–Β–Ϋ–Ϋ–Α―è ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Α―è ―³–Μ–Ψ―Ä–Α –Ϋ–Η–Ε–Ϋ–Η―Ö –Ψ―²–¥–Β–Μ–Ψ–≤ –Ω–Ψ–Μ–Ψ–≤―΄―Ö –Ω―É―²–Β–Ι, –Ψ―²–Μ–Η―΅–Α―é―â–Α―è―¹―è –±–Ψ–Μ―¨―à–Ψ–Ι ―Ä–Α–Ζ–Ϋ–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Ψ―¹―²―¨―é. –≠―²–Ψ –≤―΄–Ζ―΄–≤–Α–Β―² –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²―¨ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –Κ–Ψ–Φ–±–Η–Ϋ–Α―Ü–Η–Η –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, –Α–Κ―²–Η–≤–Ϋ―΄―Ö –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ–Ψ ―à–Η―Ä–Ψ–Κ–Ψ–≥–Ψ ―¹–Ω–Β–Κ―²―Ä–Α –≤–Ψ–Ζ–±―É–¥–Η―²–Β–Μ–Β–Ι –Α–Ϋ–Α―ç―Ä–Ψ–±–Ϋ―΄―Ö –Η –Α―ç―Ä–Ψ–±–Ϋ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι, –Α ―²–Α–Κ–Ε–Β –Ω―Ä–Ψ―²–Η–≤–Ψ–≥―Ä–Η–±–Κ–Ψ–≤―΄–Β –Η –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―΄–Β ―¹―Ä–Β–¥―¹―²–≤–Α [15, 19βÄ™23].
¬†¬†¬† –€–Α―¹―¹–Η–≤–Ϋ–Α―è –Α–Ϋ―²–Η–Φ–Η–Κ―Ä–Ψ–±–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –≤―΄–Ζ―΄–≤–Α–Β―² –≥–Μ―É–±–Ψ–Κ–Η–Β –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –≤–Ψ –≤―¹–Β–Φ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Η –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β, –Μ–Η―à–Α―è –Φ–Ψ―΅–Β–Ω–Ψ–Μ–Ψ–≤―É―é ―¹–Η―¹―²–Β–Φ―É –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Ι ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η, –Ϋ–Ψ –Η ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η―é –Φ―É–Μ―¨―²–Η―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ―΄―Ö –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ι ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤, –Α ―²–Α–Κ–Ε–Β –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι ―¹–Β–Μ–Β–Κ―Ü–Η–Η –Ϋ–Ψ–≤―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β –≤―¹–Β ―΅–Α―â–Β –≤–Ψ–≤–Μ–Β–Κ–Α―é―²―¹―è –≤ –Ω―Ä–Ψ―Ü–Β―¹―¹ ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ–Ψ-–≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–Μ–Ψ–≥–Η–Ι [20, 21].
–û―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²―¨―é –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö ―è–≤–Μ―è–Β―²―¹―è –Β–Β –Α–Ϋ―²–Η–Α–Ϋ–Α―ç―Ä–Ψ–±–Ϋ–Α―è –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Ϋ–Ψ―¹―²―¨, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Η–Φ–Β–Ϋ–Ϋ–Ψ –Α–Ϋ–Α―ç―Ä–Ψ–±–Α–Φ –Ω―Ä–Η–Ω–Η―¹―΄–≤–Α–Β―²―¹―è –Ϋ–Α–Η–±–Ψ–Μ―¨―à–Β–Β ―ç―²–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β –≤ ―Ä–Α–Ζ–≤–Η―²–Η–Η –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Α –≥–Ϋ–Ψ–Ι–Ϋ–Ψ-–≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Ω–Ψ―¹–Μ–Β–Ψ–Ω–Β―Ä–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι. –û–¥–Ϋ–Α–Κ–Ψ ―¹–Μ–Β–¥―É–Β―² ―É―΅–Η―²―΄–≤–Α―²―¨, ―΅―²–Ψ –Μ―é–±–Ψ–Β –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Β –Ω―Ä–Ψ―²–Β–Κ–Α–Β―² –≤ –Α―¹―¹–Ψ―Ü–Η–Α―Ü–Η–Η ―¹ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Φ –¥–Η―¹–±–Η–Ψ–Ζ–Ψ–Φ, –Α –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Α―è –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è ―¹ –Ω―Ä–Β―¹―¹–Η–Ϋ–≥–Ψ–Φ –Ϋ–Α –Α–Ϋ–Α―ç―Ä–Ψ–±–Ϋ―É―é ―³–Μ–Ψ―Ä―É –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―É―¹–Μ–Ψ–Ε–Ϋ―è–Β―² –¥–Η―¹–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η–Β ―Ä–Α―¹―¹―²―Ä–Ψ–Ι―¹―²–≤–Α –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β, –Ϋ–Ψ –Η –≤ –¥―Ä―É–≥–Η―Ö –±–Η–Ψ―²–Ψ–Ω–Α―Ö –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α. –½–Α ―¹―΅–Β―² ―ç―²–Ψ–≥–Ψ –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Β ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β ―Ä–Β–Ζ–Β―Ä–≤―É–Α―Ä–Ψ–≤ ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ ―¹ –Φ–Ϋ–Ψ–Ε–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι –Α–Ϋ―²–Η–±–Η–Ψ―²–Η–Κ–Ψ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²―¨―é [15, 23].
¬†¬† –û―¹–Ψ–±―É―é –Ψ–Ω–Α―¹–Ϋ–Ψ―¹―²―¨ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―² –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η―è –Φ―É–Μ―¨―²–Η―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ―΄―Ö –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ–Β–Ι –≤–Η–¥–Ψ–≤ Escherichia coli –Η Enterococcus faecium. –≠―²–Η –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ ―è–≤–Μ―è―é―²―¹―è –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ―΄–Φ–Η –Ψ–±–Η―²–Α―²–Β–Μ―è–Φ–Η ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α, –Η, –Κ―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –Ψ–±–Μ–Α–¥–Α―é―² ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨―é –±―΄―¹―²―Ä–Ψ –Ω―Ä–Η–Ψ–±―Ä–Β―²–Α―²―¨ ―É―¹―²–Ψ–Ι―΅–Η–≤–Ψ―¹―²―¨ –Κ–Ψ –Φ–Ϋ–Ψ–≥–Η–Φ –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α–Φ –Η –Ω–Β―Ä–Β–¥–Α–≤–Α―²―¨ –Β–Β –¥―Ä―É–≥–Η–Φ –±–Α–Κ―²–Β―Ä–Η―è–Φ. –ö–Α–Κ ―ç―à–Β―Ä–Η―Ö–Η–Η, ―²–Α–Κ –Η ―ç–Ϋ―²–Β―Ä–Ψ–Κ–Ψ–Κ–Κ–Η ―è–≤–Μ―è―é―²―¹―è –Ψ–¥–Ϋ–Η–Φ –Η–Ζ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ―΄―Ö ―É―΅–Α―¹―²–Ϋ–Η–Κ–Ψ–≤ ―Ä–Α–Ζ–≤–Η―²–Η―è –Α–Ϋ–Α―ç―Ä–Ψ–±–Ϋ–Ψ-–Α―ç―Ä–Ψ–±–Ϋ―΄―Ö –Φ–Η–Κ―¹―²-–Η–Ϋ―³–Β–Κ―Ü–Η–Ι. –·–≤–Μ―è―è―¹―¨ ―³–Α–Κ―É–Μ―¨―²–Α―²–Η–≤–Ϋ―΄–Φ–Η –Α―ç―Ä–Ψ–±–Α–Φ–Η, –Ψ–Ϋ–Η ―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ ―¹―²–Η–Φ―É–Μ–Η―Ä–Ψ–≤–Α―²―¨ ―Ä–Ψ―¹―² –Ψ–±–Μ–Η–≥–Α―²–Ϋ–Ψ-–Α–Ϋ–Α―ç―Ä–Ψ–±–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤, ―É―¹–Η–Μ–Η–≤–Α―è –Η―Ö –≤–Η―Ä―É–Μ–Β–Ϋ―²–Ϋ―΄–Ι –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ [2, 3, 21, 22].
¬†¬† –½–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―É―é –Ψ–Ω–Α―¹–Ϋ–Ψ―¹―²―¨ –≤ –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η–Η (–≤ ―¹–≤―è–Ζ–Η ―¹ –±―΄―¹―²―Ä―΄–Φ –Ω―Ä–Η–Ψ–±―Ä–Β―²–Β–Ϋ–Η–Β–Φ –Α–Ϋ―²–Η–±–Η–Ψ―²–Η–Κ–Ψ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Η –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β–Φ –Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ–Α) –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è―é―² –Η –¥―Ä―É–≥–Η–Β –Α―ç―Ä–Ψ–±–Ϋ―΄–Β –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ–Η ―³–Α–Κ―É–Μ―¨―²–Α―²–Η–≤–Ϋ–Ψ–Ι –Η ―²―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α, –≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η –±–Α–Κ―²–Β―Ä–Η–Η ―Ä–Ψ–¥–Ψ–≤ Staphylococcus, Streptococcus (–≥―Ä―É–Ω–Ω–Α B), Proteus, Klebsiella, Enterobacter –Η –¥―Ä. [15, 21].
¬†¬† –Γ–Μ–Β–¥―É–Β―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –Ϋ–Β―Ä–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η, –Ω–Ψ–Φ–Η–Φ–Ψ ―É–≥–Ϋ–Β―²–Β–Ϋ–Η―è –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄, –≤―΄–Ζ―΄–≤–Α–Β―² ―Ü–Β–Μ―΄–Ι ―Ä―è–¥ –¥―Ä―É–≥–Η―Ö –Ω–Ψ–±–Ψ―΅–Ϋ―΄―Ö –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Ι –Ϋ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ –Ε–Β–Ϋ―â–Η–Ϋ―΄, –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄–Β –Η–Ζ –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è―é―² –Ψ–Ω–Α―¹–Ϋ–Ψ―¹―²―¨ –¥–Μ―è –Β–Β –Ε–Η–Ζ–Ϋ–Η (―²–Α–±–Μ. 3).

¬†¬† –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―²―Ä–Α–¥–Η―Ü–Η–Ψ–Ϋ–Ϋ–Α―è ―ç―²–Η–Ψ―²―Ä–Ψ–Ω–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è, –Κ ―¹–Ψ–Ε–Α–Μ–Β–Ϋ–Η―é, –Ϋ–Β –≤―¹–Β–≥–¥–Α ―É―΅–Η―²―΄–≤–Α–Β―² ―²–Β―¹–Ϋ―É―é ―¹–≤―è–Ζ―¨ –Φ–Β–Ε–¥―É ―Ä–Α–Ζ–≤–Η―²–Η–Β–Φ –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ–Ψ-–≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι –≤ –Ε–Β–Ϋ―¹–Κ–Ψ–Ι ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ–Β –Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Φ–Η –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è–Φ–Η, –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α―é―â–Η–Φ–Η –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Ψ–Ϋ–Ϋ―É―é ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²―¨ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Η ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É―é―â–Η–Φ–Η ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η―é ―ç–Ϋ–¥–Ψ–≥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Η―¹―²–Ψ―΅–Ϋ–Η–Κ–Α –≤―΄―¹–Ψ–Κ–Ψ–≤–Η―Ä―É–Μ–Β–Ϋ―²–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Α–≥–Β–Ϋ―²–Ψ–≤.
¬†¬† –£ –Μ–Β―΅–Β–Ϋ–Η–Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö ―²―Ä–Β–±―É–Β―²―¹―è –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ―΄–Ι –Ω–Ψ–¥―Ö–Ψ–¥, –Ϋ–Α―Ü–Β–Μ–Β–Ϋ–Ϋ―΄–Ι –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Ϋ–Α ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–≥–Ψ ―É―Ä–Ψ–≤–Ϋ―è –≤–Ψ–Ζ–±―É–¥–Η―²–Β–Μ―è –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, –Ϋ–Ψ –Η –Ϋ–Α –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Ω―Ä–Η―΅–Β–Φ –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β, –Ϋ–Ψ –Η –≤–Ψ –≤―¹–Β―Ö –¥―Ä―É–≥–Η―Ö –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄―Ö ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ–Α―Ö –Ε–Β–Ϋ―¹–Κ–Ψ–≥–Ψ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Ω–Η―â–Β–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ–Φ ―²―Ä–Α–Κ―²–Β, –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α –Κ–Ψ―²–Ψ―Ä–Ψ–≥–Ψ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―²–Β―¹–Ϋ–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Α ―¹ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ―΄–Φ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Ψ–Φ.
¬†¬†¬† –ê–Ϋ–Α―²–Ψ–Φ–Η―΅–Β―¹–Κ–Α―è –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²―¨ ―Ä–Α―¹–Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Η―è –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Η –Α–Ϋ―É―¹–Α –Ψ–±–Β―¹–Ω–Β―΅–Η–≤–Α–Β―² –≤―΄―¹–Ψ–Κ―É―é ―΅–Α―¹―²–Ψ―²―É –Ψ–±–Φ–Β–Ϋ–Α –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η –Φ–Β–Ε–¥―É –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Ψ–Φ –Η ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ―΄–Φ ―²―Ä–Α–Κ―²–Ψ–Φ. –Θ―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ –Ω―Ä–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –¥–Η―¹–±–Η–Ψ–Ζ–Α―Ö –≤―¹–Β–≥–¥–Α ―Ä–Β–Ζ–Κ–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α–Β―² –≤ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–Φ ―²―Ä–Α–Κ―²–Β –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –Κ–Η―à–Β―΅–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤, ―΅–Α―â–Β –≤―¹–Β–≥–Ψ –Η–Ζ ―Ä–Ψ–¥–Ψ–≤ Bacteroides, Fusobacterium, Peptostreptococcus, Clostridium, Eubacterium, Veillonella, Escherichia, Enterococcus –Η –¥―Ä. –ü―Ä–Η ―ç―²–Ψ–Φ –≤ –Κ–Η―à–Β―΅–Ϋ–Ψ–Φ –Η –≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Α―Ö –Ζ–Α–Φ–Β―²–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄―Ö ―¹–Α―Ö–Α―Ä–Ψ–Μ–Η―²–Η―΅–Β―¹–Κ–Η―Ö –±–Α–Κ―²–Β―Ä–Η–Ι ―Ä–Ψ–¥–Ψ–≤ Bifidobacterium,
Lactobacillus –Η Propionibacterium.
¬†¬†¬† –‰–Ϋ―²–Β―Ä–Β―¹–Ϋ–Ψ –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –¥–Α–Ε–Β ―²–Α–Κ–Η–Β –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ –Κ–Α–Κ Mobiluncus, Gardnerella –Η Mycoplasma hominis, –Κ–Ψ―²–Ψ―Ä―΄–Β ―Ä–Α–Ϋ–Β–Β ―¹―΅–Η―²–Α–Μ–Η―¹―¨ –Η―¹–Κ–Μ―é―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ-–¥–Η―¹–±–Η–Ψ–Ζ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä–Ψ–Ι, –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ ―΅–Α―¹―²–Ψ –≤―΄–¥–Β–Μ―è―é―²―¹―è –Η–Ζ –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α –Η –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ ―É –Ε–Β–Ϋ―â–Η–Ϋ, –Ϋ–Ψ ―²–Α–Κ–Ε–Β ―É –Φ―É–Ε―΅–Η–Ϋ –Η –¥–Β―²–Β–Ι. –≠―²–Ψ –Β―â–Β ―Ä–Α–Ζ –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Α–Β―² –≤–Ζ–Α–Η–Φ–Ψ―¹–≤―è–Ζ―¨ –¥–Η―¹–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Ψ―Ü–Β―¹―¹–Ψ–≤, –Ω―Ä–Ψ―²–Β–Κ–Α―é―â–Η―Ö –≤ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –±–Η–Ψ―²–Ψ–Ω–Α―Ö, –Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²―¨ ―Ä–Α–Ζ―Ä–Α–±–Ψ―²–Κ–Η –Η –≤–Ϋ–Β–¥―Ä–Β–Ϋ–Η―è –≤ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ―É―é –Ω―Ä–Α–Κ―²–Η–Κ―É –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ―΄―Ö –Φ–Β―²–Ψ–¥–Ψ–≤ –Μ–Β―΅–Β–Ϋ–Η―è –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –Ψ–±―è–Ζ–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Β–Ι –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι –≤ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –±–Η–Ψ―²–Ψ–Ω–Α―Ö [9, 12, 13].
¬†¬†¬† –£ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ –≤ –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Β –≤―¹–Β ―΅–Α―â–Β –Ϋ–Α―΅–Α–Μ–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö –≤–Α–≥–Η–Ϋ–Ψ–Ζ–Ψ–≤, –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Η. –≠―²–Ψ –Ω―Ä–Β–Ω–Α―Ä–Α―²―΄, ―¹–Ψ–¥–Β―Ä–Ε–Α―â–Η–Β –Ε–Η–≤―΄–Β –Κ–Μ–Β―²–Κ–Η ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Ϋ–Ψ–Ι –¥–Μ―è ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄,―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ–Ι –Ψ–Κ–Α–Ζ―΄–≤–Α―²―¨ –Ψ–Ζ–¥–Ψ―Ä–Ψ–≤–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β –Ϋ–Α –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―΄–Β –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ―΄. –ü–Β―Ä–≤―΄–Β –≤–Α―Ä–Η–Α–Ϋ―²―΄ –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ (―ç―É–±–Η–Ψ―²–Η–Κ–Η), –Ω–Ψ―è–≤–Η–≤―à–Η–Β―¹―è –≤ ―Ä–Α―¹–Ω–Ψ―Ä―è–Ε–Β–Ϋ–Η–Η –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―΄ –Β―â–Β –≤ 70-―Ö –≥–Ψ–¥–Α―Ö –Ω―Ä–Ψ―à–Μ–Ψ–≥–Ψ ―¹―²–Ψ–Μ–Β―²–Η―è (–ë–Η―³–Η–¥―É–Φ–±–Α–Κ―²–Β―Ä–Η–Ϋ, –ö–Ψ–Μ–Η–±–Α–Κ―²–Β―Ä–Η–Ϋ, –¦–Α–Κ―²–Ψ–±–Α–Κ―²–Β―Ä–Η–Ϋ, –ë–Η―³–Η–Κ–Ψ–Μ), –Ω―Ä–Β–¥–Ϋ–Α–Ζ–Ϋ–Α―΅–Α–Μ–Η―¹―¨ –¥–Μ―è –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η ―¹–Ψ―¹―²–Α–≤–Α –Η ―¹–≤–Ψ–Ι―¹―²–≤ –Κ–Η―à–Β―΅–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄, –≤ –Ω–Β―Ä–≤―É―é –Ψ―΅–Β―Ä–Β–¥―¨, ―É –Ω–Β–¥–Η–Α―²―Ä–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö. –£ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ –Ω–Β―Ä–Β―΅–Β–Ϋ―¨ –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ –Η ―¹―³–Β―Ä–Α –Η―Ö –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―Ä–Α―¹―à–Η―Ä–Η–Μ–Η―¹―¨. –€–Ϋ–Ψ–≥–Η–Β –Η–Ζ –Ϋ–Η―Ö ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥―É―é―²―¹―è –¥–Μ―è –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Κ–Η―à–Β―΅–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι, –Ϋ–Ψ –Η –Α–Κ―É―à–Β―Ä―¹–Κ–Ψ-–≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Ω–Α―²–Ψ–Μ–Ψ–≥–Η–Η. –û–¥–Ϋ–Α–Κ–Ψ, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α ―²–Β―¹–Ϋ―É―é –≤–Ζ–Α–Η–Φ–Ψ―¹–≤―è–Ζ―¨ –≤ –Ε–Β–Ϋ―¹–Κ–Ψ–Φ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –Φ–Β–Ε–¥―É –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α–Φ–Η –Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ –Η –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Ψ–≤, ―É―¹–Μ–Ψ–≤–Η―è –¥–Μ―è –Ε–Η–Ζ–Ϋ–Β–¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –≤ –Ϋ–Η―Ö –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―Ä–Α–Ζ–Μ–Η―΅–Α―é―²―¹―è. –ü–Ψ―ç―²–Ψ–Φ―É –¥–Α–Μ–Β–Κ–Ψ –Ϋ–Β –Κ–Α–Ε–¥―΄–Ι –Ψ–±–Μ–Η–≥–Α―²–Ϋ―΄–Ι –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ―¨ –Κ–Η―à–Β―΅–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ ―¹–Φ–Ψ–Ε–Β―² ―¹–Ψ―Ö―Ä–Α–Ϋ–Η―²―¨ ―¹–≤–Ψ―é –Ε–Η–Ζ–Ϋ–Β―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β, –Α ―²–Β–Φ –±–Ψ–Μ–Β–Β –≤ –Ϋ–Β–Φ ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä–Ψ–≤–Α―²―¨ –Η –Ψ–Κ–Α–Ζ―΄–≤–Α―²―¨ –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ―΄–Ι ―ç―³―³–Β–Κ―² –Ϋ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ [5, 15].
¬†¬† –û―¹–Ψ–±―΄–Β –Ψ–Ω–Α―¹–Β–Ϋ–Η―è –≤―΄–Ζ―΄–≤–Α–Β―² –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, ―¹–Ψ–¥–Β―Ä–Ε–Α―â–Η―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄, –Ϋ–Β –Ψ―²–Ϋ–Ψ―¹―è―â–Η–Β―¹―è –Κ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η–Φ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Β ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Η–Μ–Η ―è–≤–Μ―è―é―â–Η–Β―¹―è –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ―è–Φ–Η ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –≤–Η–¥–Ψ–≤. –£–≤–Β–¥–Β–Ϋ–Η–Β ―²–Α–Κ–Η―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –≤ –≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ―΄–Ι ―²―Ä–Α–Κ―² –Φ–Ψ–Ε–Β―² –≤―΄–Ζ―΄–≤–Α―²―¨ –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Β –¥–Η―¹–±–Η–Ψ–Ζ–Α –Ζ–Α ―¹―΅–Β―² –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι –≤ –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Φ ―Ä–Α–≤–Ϋ–Ψ–≤–Β―¹–Ϋ–Ψ–Φ ―¹–Ψ–Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η –Φ–Β–Ε–¥―É –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Α–Φ–Η –Ϋ–Ψ―Ä–Φ–Ψ―³–Μ–Ψ―Ä―΄ –Η –≤―΄–Ζ–≤–Α―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η–Β –Ϋ–Β–Ω―Ä–Β–¥―¹–Κ–Α–Ζ―É–Β–Φ―΄―Ö –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β, ―΅―²–Ψ –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ψ–Ω–Α―¹–Ϋ–Ψ –¥–Μ―è –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö. –ü–Ψ―ç―²–Ψ–Φ―É –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ―΄–Φ ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η–Β–Φ –Κ ―¹–Ψ―¹―²–Α–≤―É –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ ―è–≤–Μ―è–Β―²―¹―è –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β ―²–Ψ–Μ―¨–Κ–Ψ ―²–Β―Ö –≤–Η–¥–Ψ–≤ –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ψ―²–Ϋ–Ψ―¹―è―²―¹―è –Κ –±–Α–Κ―²–Β―Ä–Η―è–Φ –≥―Ä―É–Ω–Ω―΄ Doderlein, ―è–≤–Μ―è―é―²―¹―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Ϋ―΄–Φ–Η –¥–Μ―è –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α –Ε–Β–Ϋ―â–Η–Ϋ―΄ –Η –Ϋ–Β ―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄ –≤―΄–Ζ―΄–≤–Α―²―¨ –Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ―΄―Ö –Ω–Ψ–±–Ψ―΅–Ϋ―΄―Ö ―Ä–Β–Α–Κ―Ü–Η–Ι [3, 15].
¬†¬† –‰―¹―Ö–Ψ–¥―è –Η–Ζ ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö –Ϋ–Α―É–Κ–Η, –Κ–Α―¹–Α―é―â–Η―Ö―¹―è –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²–Β–Ι –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ―΄ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α, –Ϋ–Β―¹–Μ–Ψ–Ε–Ϋ–Ψ –Ω–Ψ–Ϋ―è―²―¨ –Ω―Ä–Η―΅–Η–Ϋ―΄ –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ–Ι ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Α –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤, –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β–Φ―΄―Ö –≤ –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η–Η. –û–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Η–Β ―¹–Ψ―¹―²–Α–≤–Α –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –Ψ–¥–Ϋ–Η–Φ –Η–Μ–Η –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η–Φ–Η ―à―²–Α–Φ–Φ–Α–Φ–Η –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι ―³–Μ–Ψ―Ä―΄ –Ϋ–Β –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² ―¹–Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Η―Ä–Ψ–≤–Α―²―¨ –≤ –Ϋ–Β–Φ –≤–Β―¹―¨ –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Ι –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ, ―¹–≤–Ψ–Ι―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι –Φ–Ϋ–Ψ–≥–Ψ–Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ϋ–Ψ–Φ―É –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ―É –Ϋ–Ψ―Ä–Φ–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ―É. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –±–Ψ–Μ―¨―à–Α―è ―΅–Α―¹―²―¨ –Η–Ζ–≤–Β―¹―²–Ϋ―΄―Ö –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ –Ω―Ä–Β–¥–Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Α –¥–Μ―è –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η –Κ–Η―à–Β―΅–Ϋ―΄―Ö –¥–Η―¹–±–Η–Ψ–Ζ–Ψ–≤ –Η –Ϋ–Β –Ψ–±–Μ–Α–¥–Α–Β―² ―¹–≤–Ψ–Ι―¹―²–≤–Α–Φ–Η, –Κ–Ψ―²–Ψ―Ä―΄–Β ―è–≤–Μ―è―é―²―¹―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –Ζ–Ϋ–Α―΅–Η–Φ―΄–Φ–Η –¥–Μ―è –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Ψ―Ä–Φ–Ψ―³–Μ–Ψ―Ä―΄, –≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η –¥–Μ―è –Β–Β –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η–Η –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β.
¬†¬†¬† –≠―²–Ψ, –≤ –Ω–Β―Ä–≤―É―é –Ψ―΅–Β―Ä–Β–¥―¨, ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨ –Α–Κ―²–Η–≤–Ϋ–Ψ ―³–Β―Ä–Φ–Β–Ϋ―²–Η―Ä–Ψ–≤–Α―²―¨ –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ ―¹ –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –ö–Π–•–ö, –Ω―Ä–Ψ–¥―É―Ü–Η―Ä–Ψ–≤–Α―²―¨ –Ω–Β―Ä–Β–Κ–Η―¹―¨ –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α –Η –Μ–Η–Ζ–Ψ―Ü–Η–Φ, ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –≤–Η―²–Α–Φ–Η–Ϋ―΄ –Η –Ω–Ψ–Μ–Η―¹–Α―Ö–Α―Ä–Η–¥―΄, –Η–Ϋ–≥–Η–±–Η―Ä–Ψ–≤–Α―²―¨ ―Ä–Ψ―¹―² ―à–Η―Ä–Ψ–Κ–Ψ–≥–Ψ ―¹–Ω–Β–Κ―²―Ä–Α –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α.
¬†¬†¬† –Γ–Μ–Β–¥―É–Β―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Β –Φ–Ψ–Μ–Ψ―΅–Ϋ–Ψ–Κ–Η―¹–Μ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Ι, ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥―É–Β–Φ―΄―Ö –¥–Μ―è –Α–Κ―É―à–Β―Ä―¹–Κ–Ψ-–≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö ―Ü–Β–Μ–Β–Ι, –Ω―Ä–Η –Η―Ö –Φ–Β―¹―²–Ϋ–Ψ–Φ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η –Α–Κ―²–Η–≤–Η–Ζ–Η―Ä―É―é―² ―Ä–Ψ―¹―² –¥―Ä–Ψ–Ε–Ε–Β–Ω–Ψ–¥–Ψ–±–Ϋ―΄―Ö –≥―Ä–Η–±–Ψ–≤ –Η –≤―΄–Ζ―΄–≤–Α―é―² ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Μ–Η –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η―è –≤―É–Μ―¨–≤–Ψ–≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –Φ–Η–Κ–Ψ–Ζ–Ψ–≤, –Ω–Ψ–Μ―É―΅–Η–≤―à–Η―Ö –≤ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ ―à–Η―Ä–Ψ–Κ–Ψ–Β ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Η–Β. –≠―²–Ψ ―²―Ä–Β–±―É–Β―² –Ψ―¹–Ψ–±–Ψ–Ι –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ―¹―²–Η –Ω―Ä–Η –≤―΄–±–Ψ―Ä–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –¥–Μ―è –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Ω–Β―Ä–Η–Ψ–¥ –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η.
¬†¬† –£―΄–Ζ―΄–≤–Α–Β―² ―¹–Ψ–Φ–Ϋ–Β–Ϋ–Η―è –Η ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Μ–Η–Ψ―³–Η–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ―΄ –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤. –‰–Ζ–≤–Β―¹―²–Ϋ–Ψ, ―΅―²–Ψ –Μ–Η–Ψ―³–Η–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Α―è –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ –≤–Ψ―¹―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α–Β―² ―¹–≤–Ψ―é –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ (8 ―΅ –Η –±–Ψ–Μ–Β–Β –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² ―É―¹–Μ–Ψ–≤–Η–Ι ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η). –û―΅–Β–≤–Η–¥–Ϋ–Ψ, ―΅―²–Ψ –≤–≤–Β–¥–Β–Ϋ–Η–Β ―¹―É―¹–Ω–Β–Ϋ–Ζ–Η–Η –Μ–Η–Ψ―³–Η–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Α –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β, –Ϋ–Α―¹―΄―â–Β–Ϋ–Ϋ–Ψ–Β –±–Ψ–Μ―¨―à–Η–Φ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ–Φ –Α–Κ―²–Η–≤–Ϋ―΄―Ö –Κ–Μ–Β―²–Ψ–Κ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –Η –Β–Β –Α–Ϋ―²–Η–Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄―Ö –Φ–Β―²–Α–±–Ψ–Μ–Η―²–Ψ–≤, –±―É–¥–Β―² ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α―²―¨―¹―è –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ–Ι –≥–Η–±–Β–Μ―¨―é –≤–≤–Ψ–¥–Η–Φ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Ι –Η ―Ä–Β–Ζ–Κ–Η–Φ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ –Η―Ö –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –Β―â–Β –¥–Ψ –Ϋ–Α―΅–Α–Μ–Α –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―è –Ε–Η–Ζ–Ϋ–Β―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²–Η.
¬†¬†¬† –ö ―¹–Ψ–Ε–Α–Μ–Β–Ϋ–Η―é, –Ω―Ä–Η –Μ–Β―΅–Β–Ϋ–Η–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –¥–Η―¹–±–Η–Ψ–Ζ–Ψ–≤ –Ψ―΅–Β–Ϋ―¨ ―Ä–Β–¥–Κ–Ψ ―É―΅–Η―²―΄–≤–Α–Β―²―¹―è ―²–Ψ―² ―³–Α–Κ―², ―΅―²–Ψ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β –≤ –Μ―é–±–Ψ–Φ –±–Η–Ψ―²–Ψ–Ω–Β –Ϋ–Β –Ω―Ä–Ψ―²–Β–Κ–Α–Β―² –Η–Ζ–Ψ–Μ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ –Ψ―² –¥―Ä―É–≥–Η―Ö –Φ–Η–Κ―Ä–Ψ–±–Ϋ―΄―Ö ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ –Η, –≤ –Ω–Β―Ä–≤―É―é –Ψ―΅–Β―Ä–Β–¥―¨, ―¹–Ψ―΅–Β―²–Α–Β―²―¹―è ―¹ –¥–Η―¹–±–Η–Ψ–Ζ–Ψ–Φ –Ω–Η―â–Β–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α, –Κ–Ψ―²–Ψ―Ä―΄–Ι ―è–≤–Μ―è–Β―²―¹―è –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄–Φ ―Ä–Β–Ζ–Β―Ä–≤―É–Α―Ä–Ψ–Φ –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α. –ü–Ψ―ç―²–Ψ–Φ―É –Η–Ϋ―²―Ä–Α–≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Α―è –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Α―è ―²–Β―Ä–Α–Ω–Η―è –Ϋ–Η–Κ–Ψ–≥–¥–Α –Ϋ–Β –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ ―¹―²–Ψ–Ι–Κ–Ψ–Φ―É –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Φ―É ―ç―³―³–Β–Κ―²―É –±–Β–Ζ –Ω–Α―Ä–Α–Μ–Μ–Β–Μ―¨–Ϋ–Ψ–Ι –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η ―¹–Ψ―¹―²–Α–≤–Α –Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α.
¬†¬†¬† –£ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ –≤ –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö ―Ö–Ψ―Ä–Ψ―à–Ψ –Ζ–Α―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α–Μ ―¹–Β–±―è –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι –Φ―É–Μ―¨―²–Η–Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ –Γ–Η–Φ–±–Η―²–Β―Ä-2, ―¹–Ω–Β―Ü–Η–Α–Μ―¨–Ϋ–Ψ ―¹–Ψ–Ζ–¥–Α–Ϋ–Ϋ―΄–Ι –¥–Μ―è –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ ―¹ ―É―΅–Β―²–Ψ–Φ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ―΄―Ö –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Β–Ι –Ϋ–Ψ―Ä–Φ–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Α. –ü―Ä–Β–Ω–Α―Ä–Α―² ―¹–Ψ–¥–Β―Ä–Ε–Η―² 24 ―à―²–Α–Φ–Φ–Α –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η―Ö –±–Α–Κ―²–Β―Ä–Η–Ι, –≤―΄–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö –Η–Ζ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –±–Η–Ψ―²–Ψ–Ω–Ψ–≤ –Ζ–¥–Ψ―Ä–Ψ–≤―΄―Ö –Ε–Β–Ϋ―â–Η–Ϋ ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α. –û―¹–Ϋ–Ψ–≤―É –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Α ―¹–Ψ―¹―²–Α–≤–Μ―è―é―² –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ–Η ―Ä–Ψ–¥–Ψ–≤ Lactobacillus, Bifidobacterium –Η Propionibacterium, ―². –Β. –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²―΄ –Ϋ–Ψ―Ä–Φ–Ψ―³–Μ–Ψ―Ä―΄ –Ζ–¥–Ψ―Ä–Ψ–≤–Ψ–Ι –Ε–Β–Ϋ―â–Η–Ϋ―΄. –Γ–Η–Φ–±–Η―²–Β―Ä-2 –Α–Κ―²–Η–≤–Ϋ–Ψ ―³–Β―Ä–Φ–Β–Ϋ―²–Η―Ä―É–Β―² –≥–Μ–Η–Κ–Ψ–≥–Β–Ϋ ―¹ –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η–Β–Φ –ö–Π–•–ö (–Ω―Ä–Β–Η–Φ―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Φ–Ψ–Μ–Ψ―΅–Ϋ–Ψ–Ι, ―É–Κ―¹―É―¹–Ϋ–Ψ–Ι –Η –Ω―Ä–Ψ–Ω–Η–Ψ–Ϋ–Ψ–≤–Ψ–Ι –Κ–Η―¹–Μ–Ψ―²), –Ω–Ψ–¥–¥–Β―Ä–Ε–Η–≤–Α―é―â–Η―Ö ―Ä–ù –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―¹–Β–Κ―Ä–Β―²–Α –Ϋ–Α ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Φ ―É―Ä–Ψ–≤–Ϋ–Β; –Η–Ϋ–≥–Η–±–Η―Ä―É–Β―² ―Ä–Ψ―¹―² ―à–Η―Ä–Ψ–Κ–Ψ–≥–Ψ ―¹–Ω–Β–Κ―²―Ä–Α –Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –Η ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤; –Ω–Ψ–¥–Α–≤–Μ―è–Β―² –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –≤―Ä–Β–¥–Ϋ―΄―Ö, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Κ–Α–Ϋ―Ü–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö ―³–Β―Ä–Φ–Β–Ϋ―²–Ψ–≤;―Ä–Α–Ζ―Ä―É―à–Α–Β―² ―²–Ψ–Κ―¹–Η―΅–Β―¹–Κ–Η–Β ―¹―É–±―¹―²–Α–Ϋ―Ü–Η–Η; –Ω―Ä–Β–¥―É–Ω―Ä–Β–Ε–¥–Α–Β―² ―²―Ä–Α–Ϋ―¹–Μ–Ψ–Κ–Α―Ü–Η―é –Ε–Η–≤―΄―Ö –Κ–Μ–Β―²–Ψ–Κ –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤ –Η –Η―Ö –Φ–Β―²–Α–±–Ψ–Μ–Η―²–Ψ–≤ –≤–Ψ –≤–Ϋ―É―²―Ä–Β–Ϋ–Ϋ―é―é ―¹―Ä–Β–¥―É –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α; ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä―É–Β―² –Ω–Β―Ä–Β–Κ–Η―¹―¨ –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α, –Μ–Η–Ζ–Ψ―Ü–Η–Φ, –±–Α–Κ―²–Β―Ä–Η–Ψ―Ü–Η–Ϋ―΄; –Ω―Ä–Ψ–¥―É―Ü–Η―Ä―É–Β―² –≤–Η―²–Α–Φ–Η–Ϋ―΄ –≥―Ä―É–Ω–Ω―΄ –£, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –≤–Η―²–Α–Φ–Η–Ϋ –£12; ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä―É–Β―² –Ω–Ψ–Μ–Η―¹–Α―Ö–Α―Ä–Η–¥―΄, ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É―é―â–Η–Β ―É–Ω–Μ–Ψ―²–Ϋ–Β–Ϋ–Η―é –Ζ–Α―â–Η―²–Ϋ–Ψ–Ι –±–Η–Ψ–Ω–Μ–Β–Ϋ–Κ–Η, –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η–Η –±–Α–Κ―²–Β―Ä–Η–Ι –≥―Ä―É–Ω–Ω―΄ Doderlein –Η ―¹―²–Η–Φ―É–Μ―è―Ü–Η–Η –Η–Φ–Φ―É–Ϋ–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄; –Α–Κ―²–Η–≤–Ϋ–Ψ –≤–Ψ―¹―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α–Β―² –Ϋ–Ψ―Ä–Φ–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ. –Γ–Η–Φ–±–Η―²–Β―Ä-2 βÄî ―ç―²–Ψ ¬Ϊ–Ε–Η–≤–Α―è¬Μ ―³–Ψ―Ä–Φ–Α –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Α, –Κ–Ψ―²–Ψ―Ä–Α―è –Ϋ–Β ―²―Ä–Β–±―É–Β―² –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η –¥–Μ―è ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η. –£ –Ψ–¥–Ϋ–Ψ–Ι –¥–Ψ–Ζ–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α ―¹–Ψ–¥–Β―Ä–Ε–Η―²―¹―è (1βÄ™5)―Ö1012 –Α–Κ―²–Η–≤–Ϋ―΄―Ö –Κ–Μ–Β―²–Ψ–Κ –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η―Ö –±–Α–Κ―²–Β―Ä–Η–Ι. –£―΄―¹–Ψ–Κ–Ψ–Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² –±–Ψ–Μ–Β–Β ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ–Φ―É –Ω―Ä–Ψ―Ü–Β―¹―¹―É –Κ–Ψ–Μ–Ψ–Ϋ–Η–Ζ–Α―Ü–Η–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Α –Α–Κ―²–Η–≤–Ϋ―΄–Φ–Η –±–Α–Κ―²–Β―Ä–Η―è–Φ–Η –≥―Ä―É–Ω–Ω―΄ Doderlein –Η ―ç–Μ–Η–Φ–Η–Ϋ–Α―Ü–Η–Η –Η–Ζ –Ϋ–Β–≥–Ψ ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä―΄. –Γ–Η–Φ–±–Η―²–Β―Ä-2 ―¹–Ψ–¥–Β―Ä–Ε–Η―² –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η–Β –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄, ―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄–Β –≤–Ψ―¹―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α―²―¨ –Η–Ϋ–¥–Η–≥–Β–Ϋ–Ϋ―É―é ―³–Μ–Ψ―Ä―É –≤–Ψ –≤―¹–Β―Ö –±–Η–Ψ―²–Ψ–Ω–Α―Ö ―ç–Ϋ–¥–Ψ–Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄ –Ε–Β–Ϋ―â–Η–Ϋ―΄. –ü–Ψ―ç―²–Ψ–Φ―É –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ ―Ä–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ: –Ω–Β―Ä–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ, –Η–Ϋ―²―Ä–Α–≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ –Η ―Ä–Β–Κ―²–Α–Μ―¨–Ϋ–Ψ. –Δ–Α–Κ–Ψ–Ι –Φ–Β―²–Ψ–¥ –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η, ―É―΅–Η―²―΄–≤–Α―é―â–Η–Ι ―²–Β―¹–Ϋ―É―é –≤–Ζ–Α–Η–Φ–Ψ―¹–≤―è–Ζ―¨ –Φ–Β–Ε–¥―É ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Φ–Η –Μ–Ψ–Κ–Α–Μ―¨–Ϋ―΄–Φ–Η ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ–Α–Φ–Η, –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² –¥–Ψ―¹―²–Η―΅―¨ ―¹―²–Ψ–Ι–Κ–Ψ–≥–Ψ –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―è –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –±–Μ–Α–≥–Ψ–Ω–Ψ–Μ―É―΅–Η―è –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –Η –Μ–Η–Κ–≤–Η–¥–Α―Ü–Η–Η –≤―¹–Β―Ö –Ψ―΅–Α–≥–Ψ–≤ –Α–≥―Ä–Β―¹―¹–Η–≤–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ [5, 9, 12, 13, 15, 22, 23].
¬†¬†¬† –€―É–Μ―¨―²–Η–Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ϋ―΄–Ι ―¹–Ψ―¹―²–Α–≤, –≤―΄―¹–Ψ–Κ–Ψ–Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Α―è –Α–Κ―²–Η–≤–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –Η ―à–Η―Ä–Ψ–Κ–Η–Ι ―¹–Ω–Β–Κ―²―Ä –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö ―¹–≤–Ψ–Ι―¹―²–≤ –Γ–Η–Φ–±–Η―²–Β―Ä–Α-2 –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² –Β–≥–Ψ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨ –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Α–Κ―É―à–Β―Ä―¹–Κ–Ψ-–≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ–Ψ_–≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄–Φ–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η. –£ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η, –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ ―É―¹–Ω–Β―à–Ϋ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β―²―¹―è –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ ―Ä–Α–Ζ―Ä–Α–±–Ψ―²–Α–Ϋ–Ϋ―΄–Φ–Η ―¹―Ö–Β–Φ–Α–Φ–Η –≤ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄–Φ–Η –≤–Α–≥–Η–Ϋ–Ψ–Ζ–Α–Φ–Η; –Φ–Η–Κ–Ψ–Ζ–Ϋ―΄–Φ–Η –≤―É–Μ―¨–≤–Ψ–≤–Α–≥–Η–Ϋ–Η―²–Α–Φ–Η; –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η, –Ω–Β―Ä–Β–¥–Α―é―â–Η–Φ–Η―¹―è –Ω–Ψ–Μ–Ψ–≤―΄–Φ –Ω―É―²–Β–Φ; –≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄–Φ–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –Φ–Α–Μ–Ψ–≥–Ψ ―²–Α–Ζ–Α (–Κ–Ψ–Μ―¨–Ω–Η―²–Ψ–Φ, ―Ü–Β―Ä–≤–Η―Ü–Η―²–Ψ–Φ, ―ç–Ϋ–¥–Ψ–Φ–Β―²―Ä–Η―²–Ψ–Φ, ―¹–Α–Μ―¨–Ω–Η–Ϋ–≥–Η―²–Ψ–Φ, –Ψ–Ψ―³–Ψ―Ä–Η―²–Ψ–Φ, –Φ–Η–Ψ–Φ–Β―²―Ä–Η―²–Ψ–Φ, –Ω–Β―Ä–Η―²–Ψ–Ϋ–Η―²–Ψ–Φ) [5, 9, 12, 13, 15, 24].
¬†¬†¬† –ü–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Γ–Η–Φ–±–Η―²–Β―Ä-2 ―¹–Ψ–¥–Β―Ä–Ε–Η―² ―²–Ψ–Μ―¨–Κ–Ψ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Ϋ―É―é –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―É –Η ―è–≤–Μ―è–Β―²―¹―è –Α–±―¹–Ψ–Μ―é―²–Ϋ–Ψ –±–Β–Ζ–Ψ–Ω–Α―¹–Ϋ―΄–Φ –¥–Μ―è –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, ―Ä–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄–Φ ―è–≤–Μ―è–Β―²―¹―è–Β–≥–Ψ ―à–Η―Ä–Ψ–Κ–Ψ–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –≤ –Α–Κ―É―à–Β―Ä―¹―²–≤–Β. –£―΄―¹–Ψ–Κ–Α―è –≤–Η―²–Α–Φ–Η–Ϋ–Ψ―¹–Η–Ϋ―²–Β–Ζ–Η―Ä―É―é―â–Α―è –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Α, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ–Ψ –≤–Η―²–Α–Φ–Η–Ϋ–Α –£12, –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α―²―¨ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Η –¥–Μ―è –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Η –Α–Ϋ–Β–Φ–Η–Ι –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö. –û–Ϋ ―²–Α–Κ–Ε–Β –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β―²―¹―è –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Ω–Η–Β–Μ–Ψ–Ϋ–Β―³―Ä–Η―²–Α, ―Ö–Ψ―Ä–Η–Α–Φ–Ϋ–Η–Ψ–Ϋ–Η―²–Α –Ω―Ä–Η –Ω―Ä–Β–Ε–¥–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ–Φ ―Ä–Α–Ζ―Ä―΄–≤–Β –Ω–Μ–Ψ–¥–Ϋ―΄―Ö –Ψ–±–Ψ–Μ–Ψ―΅–Β–Κ, –≤ –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β –Ω–Β―Ä–Η―²–Ψ–Ϋ–Η―²–Α –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–¥–Ψ―Ä–Α–Ζ―Ä–Β―à–Β–Ϋ–Η―è –Ω―É―²–Β–Φ –Κ–Β―¹–Α―Ä–Β–≤–Α ―¹–Β―΅–Β–Ϋ–Η―è, –¥–Μ―è ―¹–Α–Ϋ–Α―Ü–Η–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Ω–Β―Ä–Β–¥ ―Ä–Ψ–¥–Α–Φ–Η, –¥–Μ―è –Ω―Ä–Β–¥―É–Ω―Ä–Β–Ε–¥–Β–Ϋ–Η―è –Ω–Ψ―¹–Μ–Β―Ä–Ψ–¥–Ψ–≤―΄―Ö –≥–Ϋ–Ψ–Ι–Ϋ–Ψ-―¹–Β–Ω―²–Η―΅–Β―¹–Κ–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, –¥–Μ―è ―¹–Α–Ϋ–Α―Ü–Η–Η –Φ–Ψ–Μ–Ψ―΅–Ϋ―΄―Ö –Ε–Β–Μ–Β–Ζ –Η –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Η –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι ―É –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄―Ö.
¬†¬† –‰―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Γ–Η–Φ–±–Η―²–Β―Ä–Α-2 –≤ –Μ–Β―΅–Β–Ϋ–Η–Η ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹–Ϋ–Η–Ε–Α–Β―² ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Ω–Ψ―¹–Μ–Β–Ψ–Ω–Β―Ä–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –Η ―É―¹–Κ–Ψ―Ä―è–Β―² –Ω―Ä–Ψ―Ü–Β―¹―¹ ―Ä–Β–Κ–Ψ–Ϋ–≤–Α–Μ–Β―¹―Ü–Β–Ϋ―Ü–Η–Η [5, 12, 13, 15, 23, 24].
–€–Α―²–Β―Ä–Η–Α–Μ –Η –Φ–Β―²–Ψ–¥―΄ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è
¬†¬†¬† –‰–Ζ―É―΅–Α–Μ–Α―¹―¨ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Α―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Γ–Η–Φ–±–Η―²–Β―Ä–Α-2 –Ω―Ä–Η –Μ–Β―΅–Β–Ϋ–Η–Η 146 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–Κ ―¹ –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄–Φ –≤–Α–≥–Η–Ϋ–Ψ–Ζ–Ψ–Φ.

¬†¬†¬† –ö–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ―É―é –≥―Ä―É–Ω–Ω―É ―¹–Ψ―¹―²–Α–≤–Η–Μ–Η ―²–Α–Κ–Ε–Β 146 –±–Ψ–Μ―¨–Ϋ―΄―Ö. –Ξ–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α –≥―Ä―É–Ω–Ω –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Α –≤ ―²–Α–±–Μ–Η―Ü–Β 4. –ö–Α–Κ –≤–Η–¥–Ϋ–Ψ –Η–Ζ –Ω―Ä–Η–≤–Β–¥–Β–Ϋ–Ϋ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö, –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Α―è –Η –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ–Α―è –≥―Ä―É–Ω–Ω―΄ –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ω–Ψ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤―É –Ω–Α―Ä–Α–Φ–Β―²―Ä–Ψ–≤ –Η–Φ–Β–Μ–Η –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―¹―Ö–Ψ–¥―¹―²–≤–Ψ.
¬†¬†¬† –ë–Ψ–Μ―¨–Ϋ―΄–Β –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ (146 ―΅–Β–Μ–Ψ–≤–Β–Κ) –≤ ―²–Β―΅–Β–Ϋ–Η–Β –≤―¹–Β–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α –Μ–Β―΅–Β–Ϋ–Η―è (17 ―¹―É―²–Ψ–Κ) –Ω–Ψ–Μ―É―΅–Α–Μ–Η per os –Γ–Η–Φ–±–Η―²–Β―Ä-2 (–Ω–Ψ 1 –¥–Ψ–Ζ–Β –≤ ―¹―É―²–Κ–Η –≤–Ψ –≤―Ä–Β–Φ―è –Η–Μ–Η –Ω–Ψ―¹–Μ–Β –Β–¥―΄). –û–¥–Ϋ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η –Η–Ϋ―²―Ä–Α–≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―É―é ―²–Β―Ä–Α–Ω–Η―é –≤―¹–Β―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö, –Κ–Ψ―²–Ψ―Ä–Α―è ―¹–Ψ―¹―²–Ψ―è–Μ–Α –Η–Ζ ―ç―²–Α–Ω–Ψ–≤ –Ω–Ψ–¥–≥–Ψ―²–Ψ–≤–Κ–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Η –Φ–Β―¹―²–Ϋ–Ψ–Ι –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ―²–Β―Ä–Α–Ω–Η–Η –Γ–Η–Φ–±–Η―²–Β―Ä–Ψ–Φ-2. –Γ ―ç―²–Ψ–Ι ―Ü–Β–Μ―¨―é –≤ ―²–Β―΅–Β–Ϋ–Η–Β 7-–Φ–Η ―¹―É―²–Ψ–Κ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η ―¹–Α–Ϋ–Α―Ü–Η―é –≤–Μ–Α–≥–Α–Μ–Η―â–Α 3%-–Ϋ―΄–Φ ―Ä–Α―¹―²–≤–Ψ―Ä–Ψ–Φ –Φ–Ψ–Μ–Ψ―΅–Ϋ–Ψ–Ι –Κ–Η―¹–Μ–Ψ―²―΄ ―¹ ―ç–Κ―¹–Ω–Ψ–Ζ–Η―Ü–Η–Β–Ι 10βÄ™20 –Φ–Η–Ϋ (50βÄ™100 ―¹–Φ3 ―Ä–Α―¹―²–≤–Ψ―Ä–Α), –Ω–Ψ―¹–Μ–Β ―΅–Β–≥–Ψ –≤–Ψ –≤–Μ–Α–≥–Α–Μ–Η―â–Β –≤–≤–Ψ–¥–Η–Μ―¹―è –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Ι –Κ―Ä–Β–Φ –Η–Μ–Η ―¹―É–Ω–Ω–Ψ–Ζ–Η―²–Ψ―Ä–Η–Ι –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è (–¥–Α–Μ–Α―Ü–Η–Ϋ –Η–Μ–Η –Κ–Μ–Ψ―²―Ä–Η–Φ–Α–Ζ–Ψ–Μ).
¬†¬†¬† –ü–Ψ―¹–Μ–Β –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è ―²–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ ―ç―²–Η–Ψ―²―Ä–Ψ–Ω–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η, –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Ϋ–Ψ–Ι –Ϋ–Α ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –≤ ―É―Ä–Ψ–≥–Β–Ϋ–Η―²–Α–Μ―¨–Ϋ–Ψ–Φ ―²―Ä–Α–Κ―²–Β –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–≥–Ψ ―É―Ä–Ψ–≤–Ϋ―è –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ψ–≤, –≤ ―²–Β―΅–Β–Ϋ–Η–Β 10 –Ω–Ψ―¹–Μ–Β–¥―É―é―â–Η―Ö ―¹―É―²–Ψ–Κ –Ϋ–Α –Ϋ–Ψ―΅―¨ –Ϋ–Α ―²–Α–Φ–Ω–Ψ–Ϋ–Α―Ö –≤–≤–Ψ–¥–Η–Μ–Η –Η–Ϋ―²―Ä–Α–≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ –Γ–Η–Φ–±–Η―²–Β―Ä-2, –Ω―Ä–Β–¥–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ ―Ä–Α–Ζ–≤–Β–¥–Β–Ϋ–Ϋ―΄–Ι –≤ 2βÄ™3 ―Ä–Α–Ζ–Α ―²–Β–Ω–Μ–Ψ–Ι –Κ–Η–Ω―è―΅–Β–Ϋ–Ψ–Ι –≤–Ψ–¥–Ψ–Ι –Η–Μ–Η ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ ―Ä–Α―¹―²–≤–Ψ―Ä–Ψ–Φ (1 –¥–Ψ–Ζ–Α –≤ ―¹―É―²–Κ–Η).
¬†¬†¬† –ë–Ψ–Μ―¨–Ϋ―΄–Φ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ (146 ―΅–Β–Μ–Ψ–≤–Β–Κ) –Ϋ–Α–Ζ–Ϋ–Α―΅–Α–Μ–Η ―²―Ä–Α–¥–Η―Ü–Η–Ψ–Ϋ–Ϋ―É―é –Φ–Β―¹―²–Ϋ―É―é ―²–Β―Ä–Α–Ω–Η―é ―¹ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ –Α–Ϋ―²–Η―¹–Β–Ω―²–Η–Κ–Α –Η –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ―Ä–Β–Φ–Α –Η–Μ–Η ―¹―É–Ω–Ω–Ψ–Ζ–Η―²–Ψ―Ä–Η―è. –î–Ψ –Η –Ω–Ψ―¹–Μ–Β –Μ–Β―΅–Β–Ϋ–Η―è ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ψ–±–Β–Η―Ö –≥―Ä―É–Ω–Ω –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Μ―¹―è –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ―΄–Ι –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ (―΅–Α―¹―²–Ψ―²–Α –≤―΄–¥–Β–Μ–Β–Ϋ–Η―è –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –Η –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –Κ–Μ–Β―²–Ψ–Κ, lg –ö–û–ï –≤ 1 ―¹–Φ3 ―¹–Β–Κ―Ä–Β―²–Α).
–†–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –Η –Η―Ö –Ψ–±―¹―É–Ε–¥–Β–Ϋ–Η–Β
–£ ―²–Α–±–Μ–Η―Ü–Β 5 –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ―΄ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Μ–Β―΅–Β–Ϋ–Η―è –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ψ–±–Β–Η―Ö –≥―Ä―É–Ω–Ω.

¬†¬† –ö–Α–Κ –≤–Η–¥–Ϋ–Ψ –Η–Ζ –¥–Α–Ϋ–Ϋ―΄―Ö ―²–Α–±–Μ–Η―Ü―΄ 5, –Β–≥–Ψ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Ψ–Κ–Α–Ζ–Α–Μ–Α―¹―¨ –Ϋ–Α–Φ–Ϋ–Ψ–≥–Ψ –≤―΄―à–Β –Ω―Ä–Η –¥–Ψ–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Η –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Φ―É–Μ―¨―²–Η–Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–Φ –Γ–Η–Φ–±–Η―²–Β―Ä-2. –£ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω–Β –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –±–Ψ–Μ–Β–Β –±―΄―¹―²―Ä–Ψ–Β, –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –Ω–Α―Ü–Η–Β–Ϋ―²–Κ–Α–Φ–Η –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄, –Κ―É–Ω–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–Α–≥–Η–Ϋ–Ψ–Ζ–Α, ―É–Μ―É―΅―à–Β–Ϋ–Η–Β –Ψ–±―â–Β–≥–Ψ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Η ―¹–Α–Φ–Ψ―΅―É–≤―¹―²–≤–Η―è, ―΅―²–Ψ ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α–Μ–Ψ―¹―¨ –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η–Β–Φ ―¹–Ψ―¹―²–Α–≤–Α –Η ―¹–≤–Ψ–Ι―¹―²–≤ –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Ψ―Ä–Φ–Ψ–Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―²―΄ (―²–Α–±–Μ. 6, 7).
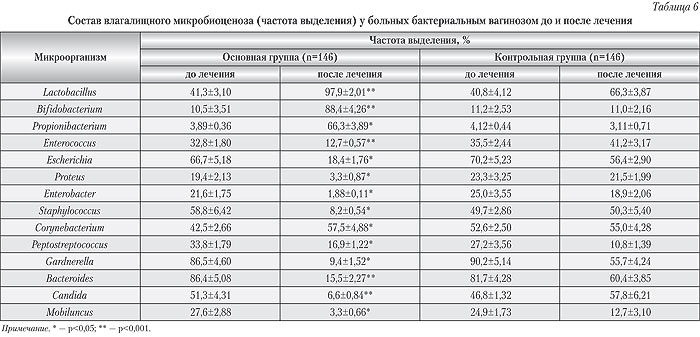

¬†¬† –ü–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄–Β ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Α―é―² –≤―΄–≤–Ψ–¥―΄ –Φ–Ϋ–Ψ–≥–Η―Ö ―¹–Ω–Β―Ü–Η–Α–Μ–Η―¹―²–Ψ–≤ –Ψ ―²–Ψ–Φ, ―΅―²–Ψ –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Η–Β –Μ–Β―΅–Β–Ϋ–Η―è –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö –≤–Α–≥–Η–Ϋ–Ψ–Ζ–Ψ–≤ –Φ–Β―¹―²–Ϋ―΄–Φ –Η–Μ–Η ―¹–Η―¹―²–Β–Φ–Ϋ―΄–Φ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ϋ–Β ―É―¹―²―Ä–Α–Ϋ―è–Β―² –Ψ―¹–Ϋ–Ψ–≤–Ϋ―É―é –Ω―Ä–Η―΅–Η–Ϋ―É –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, ―². –Β. –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –≤ –±–Η–Ψ―²–Ψ–Ω–Β, ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–Φ ―΅–Β–≥–Ψ ―è–≤–Μ―è–Β―²―¹―è –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ –≤―΄―¹–Ψ–Κ–Α―è ―΅–Α―¹―²–Ψ―²–Α ―Ä–Β―Ü–Η–¥–Η–≤–Ψ–≤ –±–Ψ–Μ–Β–Ζ–Ϋ–Η –Η –Φ–Ϋ–Ψ–≥–Η–Β ―¹–Μ―É―΅–Α–Η ―Ä–Α–Ζ–≤–Η―²–Η―è –Φ–Η–Κ–Ψ–Ζ–Ϋ–Ψ–≥–Ψ –≤―É–Μ―¨–≤–Ψ–≤–Α–≥–Η–Ϋ–Η―²–Α.
¬†¬†¬† –ü―Ä–Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η –Γ–Η–Φ–±–Η―²–Β―Ä–Α-2 ―É 93¬±2,05% (―Ä<0,05) –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–Κ –Ω–Ψ –Η―¹―²–Β―΅–Β–Ϋ–Η–Η –Κ―É―Ä―¹–Α –Μ–Β―΅–Β–Ϋ–Η―è –±―΄–Μ–Α –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Α –Ϋ–Ψ―Ä–Φ–Ψ―³–Μ–Ψ―Ä–Α –≤–Μ–Α–≥–Α–Μ–Η―â–Ϋ–Ψ–≥–Ψ –Η ―²–Ψ–Μ―¹―²–Ψ–Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ –±–Η–Ψ―²–Ψ–Ω–Ψ–≤, ―΅―²–Ψ –Ω–Ψ–Ζ–Η―²–Η–≤–Ϋ–Ψ –Ψ―²―Ä–Α–Ζ–Η–Μ–Ψ―¹―¨ –Ϋ–Α –¥–Η–Ϋ–Α–Φ–Η–Κ–Β –Κ―É–Ω–Η―Ä–Ψ–≤–Α–Ϋ–Η―è ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è.–£―΄–≤–Ψ–¥―΄
 
¬†¬† –ê–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–Β –¥–Ψ–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Β –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–≥–Ψ –Μ–Β―΅–Β–Ϋ–Η―è –±–Ψ–Μ―¨–Ϋ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄–Φ –≤–Α–≥–Η–Ϋ–Ψ–Ζ–Ψ–Φ –Ω―Ä–Ψ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η–Φ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β–Φ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Γ–Η–Φ–±–Η―²–Β―Ä–Α-2 –Ϋ–Α –Ϋ–Α―Ä―É―à–Β–Ϋ–Ϋ―É―é –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―É –≤–Μ–Α–≥–Α–Μ–Η―â–Α –Η –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α, ―è–≤–Μ―è―é―â–Η―Ö―¹―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ―΄–Φ–Η –Η ―²–Β―¹–Ϋ–Ψ –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤―É―é―â–Η–Φ–Η –Μ–Ψ–Κ―É―¹–Α–Φ–Η –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄ –Ε–Β–Ϋ―¹–Κ–Ψ–≥–Ψ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α, –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ–≤―΄―¹–Η―²―¨ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ ―²–Β―Ä–Α–Ω–Η–Η –Η ―¹–Ϋ–Η–Ζ–Η―²―¨ ―΅–Α―¹―²–Ψ―²―É ―Ä–Α–Ζ–≤–Η―²–Η―è –Ω–Ψ–±–Ψ―΅–Ϋ―΄―Ö ―ç―³―³–Β–Κ―²–Ψ–≤ –Η ―Ä–Β―Ü–Η–¥–Η–≤–Ψ–≤ –±–Ψ–Μ–Β–Ζ–Ϋ–Η. –£ ―¹–≤―è–Ζ–Η ―¹ –Ϋ–Α–±–Μ―é–¥–Α―é―â–Η–Φ―¹―è –≤ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ ―Ä–Β–Ζ–Κ–Η–Φ –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Ψ–Φ –≤ ―Ä–Α―¹―à–Η―³―Ä–Ψ–≤–Κ–Β –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤–Η–Ι –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Ψ–≤ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö ―ç–Κ–Ψ―¹–Η―¹―²–Β–Φ ―¹ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–Φ ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Η –≤ –Ω–Ψ–Ϋ–Η–Φ–Α–Ϋ–Η–Η –Ζ–Ϋ–Α―΅–Η–Φ–Ψ―¹―²–Η ―¹–Η–Φ–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ϋ–Ψ―Ä–Φ–Ψ―³–Μ–Ψ―Ä―΄ –≤ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η–Η ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Ζ–¥–Ψ―Ä–Ψ–≤―¨―è, ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Β –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Η –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Β ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄, –≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η –≤―΄―¹–Ψ–Κ–Ψ–Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι –Φ―É–Μ―¨―²–Η–Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ –Γ–Η–Φ–±–Η―²–Β―Ä-2 ―¹ ―à–Η―Ä–Ψ–Κ–Η–Φ ―¹–Ω–Β–Κ―²―Ä–Ψ–Φ –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö ―¹–≤–Ψ–Ι―¹―²–≤, –¥–Ψ–Μ–Ε–Ϋ―΄ –≤―¹–Β ―à–Η―Ä–Β –≤–Ϋ–Β–¥―Ä―è―²―¨―¹―è –≤ –Α–Κ―É―à–Β―Ä―¹–Κ–Ψ-–≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ―É―é –Ω―Ä–Α–Κ―²–Η–Κ―É.
–¦–‰–Δ–ï–†–ê–Δ–Θ–†–ê
1. –ê–Ϋ–Κ–Η―Ä―¹–Κ–Α―è –ê.–Γ. –ë–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄–Ι –≤–Α–≥–Η–Ϋ–Ψ–Ζ // –ê–Κ―É―à–Β―Ä―¹―²–≤–Ψ –Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η―è. βÄ™ 1995. βÄî ⳕ6. βÄ™ –Γ. 13βÄ™16.
2. –ù–Α―Ä―É―à–Β–Ϋ–Η―è –Φ–Η–Κ―Ä–Ψ–±–Ϋ–Ψ–Ι ―ç–Κ–Ψ–Μ–Ψ–≥–Η–Η ―΅–Β–Μ–Ψ–≤–Β–Κ–Α: –Ω―Ä–Η―΅–Η–Ϋ―΄ –Η ―¹–Μ–Β–¥―¹―²–≤–Η―è, ―¹–Ω–Ψ―¹–Ψ–±―΄ –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―è ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Ϋ–Ψ―Ä–Φ―΄ / –ë–Β―Ä–Β–Ε–Ϋ–Ψ–Ι –£.–£., –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –ö―Ä–Α–Φ–Α―Ä–Β–≤ –Γ.–ê., –®―É–Ϋ―¨–Κ–Ψ –ï.–ï., –î―΄–Φ–Β–Ϋ―² –™.–Γ. // –½–¥–Ψ―Ä–Ψ–≤―¨–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. βÄ™ 2004. βÄ™ ⳕ2(18). βÄ™ –Γ. 170βÄ™178.
3. –û ―Ü–Β–Μ–Β―¹–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Ψ―¹―²–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è ―É―¹–Μ–Ψ–≤–Ϋ–Ψ-–Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö –Φ–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Ψ–≤ –≤ ―¹–Ψ―¹―²–Α–≤–Β –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ / –ë–Β―Ä–Β–Ε–Ϋ–Ψ–Ι –£.–£., –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –ö―Ä–Α–Φ–Α―Ä–Β–≤ –Γ.–ê., –®―É–Ϋ―¨–Κ–Ψ –ï.–ï., –î―΄–Φ–Β–Ϋ―² –™.–Γ. // –½–¥–Ψ―Ä–Ψ–≤―¨–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. βÄ™ 2004. βÄ™ ⳕ3(19). βÄ™ –Γ. 191βÄ™202.
4. –Ξ–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –Ω―Ä–Η –≤–Ϋ―É―²―Ä–Η–Φ–Α―²–Ψ―΅–Ϋ–Ψ–Ι –Κ–Ψ–Ϋ―²―Ä–Α―Ü–Β–Ω―Ü–Η–Η / –ë―É―Ö–Α―Ä–Η–Ϋ –û.–£., –ö–Ψ–Ϋ―¹―²–Α–Ϋ―²–Η–Ϋ–Ψ–≤–Α –û.–î., –ö―Ä–Β–Φ–Μ–Β–≤–Α –ï.–ê., –ß–Β―Ä–Κ–Α―¹–Ψ–≤ –Γ.–£. // –•. –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ–Μ., ―ç–Ω–Η–¥–Β–Φ–Η–Ψ–Μ. –Η –Η–Φ–Φ―É–Ϋ–Ψ–Μ. βÄ™ 1999. βÄ™ ⳕ4. βÄ™ –Γ. 63βÄ™65.
5. –ü―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ –≤ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Η –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β –≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι –≤ –Α–Κ―É―à–Β―Ä―¹―²–≤–Β –Η –≥–Η–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥–Η–Η: –€–Β―²–Ψ–¥. ―Ä–Β–Κ–Ψ–Φ. / –£–Β–Ϋ―Ü–Κ–Ψ–≤―¹–Κ–Η–Ι –ë.–€., –Δ–Ψ–≤―¹―²–Α–Ϋ–Ψ–≤―¹–Κ–Α―è –£.–ê., –™―É―Ü―É–Μ―è–Κ –†.–£. –Η –¥―Ä. βÄ™ –ö., 2001. βÄ™ 28 ―¹.
6. –€–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Α―¹–Ω–Β–Κ―²―΄ ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Ζ–¥–Ψ―Ä–Ψ–≤―¨―è –Ε–Β–Ϋ―â–Η–Ϋ―΄ –Η ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Β –Ω–Ψ–¥―Ö–Ψ–¥―΄ –Κ –Β–≥–Ψ –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η―é / –£–Β–Ϋ―Ü–Κ–Ψ–≤―¹–Κ–Η–Ι –ë.–€., –Δ–Ψ–≤―¹―²–Α–Ϋ–Ψ–≤―¹–Κ–Α―è –£.–ê., –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. // –½–¥–Ψ―Ä–Ψ–≤―¨–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. βÄ™ 2002. βÄ™ ⳕ3 (11). βÄ™ –Γ. 86 βÄ™91.
7. –ë–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄–Ι –≤–Α–≥–Η–Ϋ–Ψ–Ζ / –™–Β―Ä–Α―¹–Η–Φ–Ψ–≤–Η―΅ –™.–‰., –Δ–Η―²–Ψ–≤ –¦.–ü., –ö–Ψ―Ä―à–Η–Κ–Ψ–≤–Α –†.–¦., –Γ–Α―³–Η–Ϋ–Α –€.–†. // –Θ–Κ―Ä. –Φ–Β–¥. ―΅–Α―¹–Ψ–Ω–Η―¹. βÄ™ 1998. βÄ™ ⳕ3(5). βÄ™ –Γ. 107βÄ™112.
8. –ö–Η―Ä–Α –ï.–Λ., –ë–Β―Ä–Μ–Β–≤ –‰.–£., –€–Ψ–Μ―΅–Α–Ϋ–Ψ–≤ –û.–¦. –û―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²–Η ―²–Β―΅–Β–Ϋ–Η―è –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η, ―Ä–Ψ–¥–Ψ–≤ –Η –Ω–Ψ―¹–Μ–Β―Ä–Ψ–¥–Ψ–≤–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α ―É –Ε–Β–Ϋ―â–Η–Ϋ ―¹ –¥–Η―¹–±–Η–Ψ―²–Η―΅–Β―¹–Κ–Η–Φ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è–Φ–Η –≤–Μ–Α–≥–Α–Μ–Η―â–Α // –•. –Α–Κ―É―à–Β―Ä. –Η –Ε–Β–Ϋ. –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ι. βÄ™ 1999. βÄ™ –Δ. XLVII, –£―΄–Ω. 2. βÄî –Γ. 8βÄî11.
9. –ö―Ä–Α–≤―΅–Β–Ϋ–Κ–Ψ –û.–£., –™―É―Ü―É–Μ―è–Κ –†.–£., –·–Ϋ–Κ–Ψ–≤―¹―¨–Κ–Η–Ι –î.–Γ. –½–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è –Ω―Ä–Ψ–±i–Ψ―²–Η–Κ–Α ¬Ϊ–Γ–Η–Φ–±i―²–Β―Ä¬Μ –≤ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–Φ―É –Μi–Κ―É–≤–Α–Ϋ–Ϋi –±–Α–Κ―²–Β―Ä–Α–Μ―¨–Ϋ–Η―Ö –≤–Α–≥i–Ϋ–Ψ–Ζi–≤ // –ü–Β–¥i–Α―²―Äi―è, –Α–Κ―É―à–Β―Ä―¹―²–≤–Ψ ―²–Α –≥i–Ϋ–Β–Κ–Ψ–Μ–Ψ–≥i―è. βÄî 2002. βÄî ⳕ5. βÄî –Γ. 100βÄî102.
10. –€–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―è –≤–Μ–Α–≥–Α–Μ–Η―â–Α. –ö–Ψ―Ä―Ä–Β–Κ―Ü–Η―è –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –Ω―Ä–Η –≤–Α–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –¥–Η―¹–±–Α–Κ―²–Β―Ä–Η–Ψ–Ζ–Α―Ö. –Θ―΅–Β–±–Ϋ–Ψ–Β –Ω–Ψ―¹–Ψ–±–Η–Β / –ö–Ψ―Ä―à―É–Ϋ–Ψ–≤ –£.–€., –£–Ψ–Μ–Ψ–¥–Η–Ϋ –ù.–ù., –ï―³–Η–Φ–Ψ–≤ –ë.–ê. –Η –¥―Ä. βÄî –€., 1999. βÄî 79 ―¹.
11. –€–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä–Α ―Ä–Β–Ω―Ä–Ψ–¥―É–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Ε–Β–Ϋ―â–Η–Ϋ –Ω―Ä–Η –≤–Ϋ―É―²―Ä–Η–Φ–Α―²–Ψ―΅–Ϋ―΄―Ö –≤–Φ–Β―à–Α―²–Β–Μ―¨―¹―²–≤–Α―Ö / –ö–Ψ–Ϋ―¹―²–Α–Ϋ―²–Η–Ϋ–Ψ–≤–Α –û.–î., –ö―Ä–Β–Φ–Μ–Β–≤–Α –ï.–ê., –ß–Β―Ä–Κ–Α―¹–Ψ–≤ –Γ.–£., –ß–Β―Ä―²–Κ–Ψ–≤ –ö.–¦. // –•. –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ–Μ., ―ç–Ω–Η–¥–Β–Φ–Η–Ψ–Μ. –Η –Η–Φ–Φ―É–Ϋ–Ψ–Μ. βÄî 2000. βÄî ⳕ2. βÄî –Γ. 98βÄî100.
12. –Γ–Η―¹―²–Β–Φ–Ϋ―• –Ω–Ψ―Ä―É―à–Β–Ϋ–Ϋ―è –Φ―•–Κ―Ä–Ψ–±―•–Ψ―Ü–Β–Ϋ–Ψ–Ζ―É, ―½―Ö –Ω―Ä–Ψ―³―•–Μ–Α–Κ―²–Η–Κ–Α ―²–Α –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Β –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è –Ω―Ä–Ψ–±―•–Ψ―²–Η–Κ–Α ¬Ϊ–Γ–Η–Φ–±―•―²–Β―Ä¬Μ ―É –≤–Α–≥―•―²–Ϋ–Η―Ö, –≥–Ψ–¥―É―é―΅–Η―Ö –Φ–Α―²–Β―Ä―•–≤ ―²–Α –¥―•―²–Β–Ι / –€–Α―Ä―É―à–Κ–Ψ –Δ.–¦., –·–Ϋ–Κ–Ψ–≤―¹―¨–Κ–Η–Ι –î.–Γ., –û―²―² –£.–î., –Δ―É―²―΅–Β–Ϋ–Κ–Ψ –¦.–Ü., –î–Η–Φ–Β–Ϋ―² –™.–Γ., –¦–Η―¹―è–Ϋ–Α –Δ.–û. // –ü–Β―Ä–Η–Ϋ–Α―²–Ψ–Μ–Ψ–≥―•―è ―²–Α –Ω–Β–¥―•–Α―²―Ä―•―è. βÄî 2004. βÄî ⳕ4. βÄî –Γ. 19βÄî26.
13. –û―¹–Ψ–±–Μ–Η–≤–Ψ―¹―²―• ―³–Ψ―Ä–Φ―É–≤–Α–Ϋ–Ϋ―è ―¹–Η―¹―²–Β–Φ–Η –Φ―•–Κ―Ä–Ψ–±―•–Ψ―Ü–Β–Ϋ–Ψ–Ζ―É ―É –Ϋ–Ψ–≤–Ψ–Ϋ–Α―Ä–Ψ–¥–Ε–Β–Ϋ–Η―Ö ―²–Α –Ϋ–Β–Φ–Ψ–≤–Μ―è―² ―²–Α ―à–Μ―è―Ö–Η –Ι–Ψ–≥–Ψ –Ψ–Ω―²–Η–Φ―•–Ζ–Α―Ü―•―½ / –Δ―É―²―΅–Β–Ϋ–Κ–Ψ –¦.–‰., –û―²―² –£.–î., –€–Α―Ä―É―à–Κ–Ψ –Δ.–¦. –Η –¥―Ä. // –•. –Ω―Ä–Α–Κ―². –Μ―•–Κ–Α―Ä―è. βÄî 2001. βÄî ⳕ5. βÄî –Γ. 24βÄî30.
14. –®―É–Ϋ―¨–Κ–Ψ –ï.–ï., –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –ù–Ψ–≤―΄–Ι –≤–Ζ–≥–Μ―è–¥ –Ϋ–Α ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β ―ç–Ϋ–¥–Ψ–Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―¹―²–Α―²―É―¹–Α ―É –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄―Ö –¥–Β―²–Β–Ι // –•. –Ω―Ä–Α–Κ―². –Μi–Κ–Α―Ä―è. βÄî 2003. βÄî ⳕ1. βÄî –Γ. 54βÄî61.
15. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ. –€–Η–Κ―Ä–Ψ–±–Ϋ–Α―è ―ç–Κ–Ψ–Μ–Ψ–≥–Η―è ―΅–Β–Μ–Ψ–≤–Β–Κ–Α. –Γ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Β –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ―¹―²–Η –Β–Β –Ω–Ψ–¥–¥–Β―Ä–Ε–Α–Ϋ–Η―è –Η –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―è: βÄî –ö.: –≠–Κ―¹–Ω–Β―Ä―² –¦–Δ–î, 2005. βÄî 362 ―¹.
16. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ. –Γ–Ψ―¹―²–Α–≤ –Η ―³―É–Ϋ–Κ―Ü–Η–Η –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Ψ–≤ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –±–Η–Ψ―²–Ψ–Ω–Ψ–≤ ―΅–Β–Μ–Ψ–≤–Β–Κ–Α // –½–¥–Ψ―Ä–Ψ–≤―¨–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. βÄî 2003. βÄî ⳕ4(16). βÄî –Γ. 145βÄî158.
17. –ù–Α―¹―²–Ψ―è―â–Β–Β –Η –±―É–¥―É―â–Β–Β –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ –Κ–Α–Κ –±–Η–Ψ–Κ–Ψ―Ä―Ä–Β–Κ―²–Ψ―Ä–Ψ–≤ –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι / –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –ë–Β―Ä–Β–Ε–Ϋ–Ψ–Ι –£.–£., –®―É–Ϋ―¨–Κ–Ψ –ï.–ï., –ö―Ä–Α–Φ–Α―Ä–Β–≤ –Γ.–ê., –î―΄–Φ–Β–Ϋ―² –™.–Γ. // –Γ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Α―è –Ω–Β–¥–Η–Α―²―Ä–Η―è. βÄî 2004. βÄî ⳕ1(2). βÄî –Γ. 111βÄî118.
18. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –ë–Β―Ä–Β–Ε–Ϋ–Ψ–Ι –£.–£., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –ü–Β―Ä–Β―¹–Ω–Β–Κ―²–Η–≤―΄ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –Ω―Ä–Ψ–Ω–Η–Ψ–Ϋ–Ψ–≤–Ψ–Κ–Η―¹–Μ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Ι –≤ ―¹–Ψ―¹―²–Α–≤–Β –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ // –Γ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Α―è –Ω–Β–¥–Η–Α―²―Ä–Η―è. βÄî 2004. βÄî ⳕ3(4). βÄî –Γ. 131βÄî141.
19. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –≠―Ä–Α –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤. –ü―Ä–Ψ―²–Η–≤–Ψ―Ä–Β―΅–Η―è, –Ω―Ä–Ψ–±–Μ–Β–Φ―΄, –¥–Η―¹–Κ―É―¹―¹–Η–Η // –ö–Ψ–Μ–Μ–Β–≥–Α. βÄî 2005. βÄî ⳕ 3 βÄî4.
20. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –Γ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Β –Α―¹–Ω–Β–Κ―²―΄ –Ω―Ä–Ψ–±–Μ–Β–Φ―΄ –Φ–Η–Κ―Ä–Ψ―ç–Κ–Ψ–Μ–Ψ–≥–Η–Η –Η –¥–Η―¹–±–Η–Ψ–Ζ–Ψ–≤ // –½–¥–Ψ―Ä–Ψ–≤―¨–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. βÄî 2005. ⳕ4(24). βÄî –Γ. 209βÄî218.
21. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –ü―Ä–Ψ–±–Μ–Β–Φ–Α ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Φ–Η–Κ―Ä–Ψ―³–Μ–Ψ―Ä―΄ –Κ –Α–Ϋ―²–Η–±–Η–Ψ―²–Η–Κ–Α–Φ –Η ―Ä–Ψ–Μ―¨ ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö –Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Ψ–≤ –≤ –Β–Β ―Ä–Β–Α–Μ–Η–Ζ–Α―Ü–Η–Η // –½–¥–Ψ―Ä–Ψ–≤―¨–Β –Ε–Β–Ϋ―â–Η–Ϋ―΄. βÄî 2006. βÄî ⳕ2(26).
22. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –ü―Ä–Ψ–±–Η–Ψ―²–Η–Κ–Η –Ξ–ΞI ―¹―²–Ψ–Μ–Β―²–Η―è. –î–Ψ―¹―²–Η–Ε–Β–Ϋ–Η―è, –Ω―Ä–Ψ–±–Μ–Β–Φ―΄, –¥–Η―¹–Κ―É―¹―¹–Η–Η / –†–Ψ–Μ―¨ –Ω―Ä–Ψ–±―•–Ψ―²–Η–Κ―•–≤ –≤ –Ψ―Ö–Ψ―Ä–Ψ–Ϋ―• –Ζ–¥–Ψ―Ä–Ψ–≤'―è –Φ–Α―²–Β―Ä―• ―²–Α –¥–Η―²–Η–Ϋ–Η. βÄî –ö., 2006. βÄî –Γ. 7βÄî18.
23. –·–Ϋ–Κ–Ψ–≤―¹―¨–Κ–Η–Ι –î.–Γ. –€―•–Κ―Ä–Ψ–±―•–Ψ–Μ–Ψ–≥―•―΅–Ϋ–Α ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α ―¹–Η―¹―²–Β–Φ–Η ¬Ϊ–Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ –≥–Ψ―¹–Ω–Ψ–¥–Α―Ä―è βÄî –Φ―•–Κ―Ä–Ψ–±―•–Ψ―Ü–Β–Ϋ–Ψ–Ζ–Η ―Ä―•–Ζ–Ϋ–Η―Ö –Β–Κ–Ψ–Μ–Ψ–≥―•―΅–Ϋ–Η―Ö –Ϋ―•―à¬Μ ―è–Κ –Ψ―¹–Ϋ–Ψ–≤–Α ―¹―²–≤–Ψ―Ä–Β–Ϋ–Ϋ―è –Φ―É–Μ―¨―²–Η–Ω―Ä–Ψ–±―•–Ψ―²–Η–Κ―•–≤ –Ϋ–Ψ–≤–Η―Ö –Ω–Ψ–Κ–Ψ–Μ―•–Ϋ―¨: –ê–≤―²–Ψ―Ä–Β―³. –¥–Η―¹. ... –¥-―Ä–Α–±―•–Ψ–Μ. –Ϋ–Α―É–Κ. βÄî –Ξ–Α―Ä–Κ―•–≤, 2006. βÄî 52 ―¹.
24. –·–Ϋ–Κ–Ψ–≤―¹–Κ–Η–Ι –î.–Γ., –î―΄–Φ–Β–Ϋ―² –™.–Γ. –€–Η–Κ―Ä–Ψ–Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ―΄ –Η –Ζ–¥–Ψ―Ä–Ψ–≤―¨–Β ―΅–Β–Μ–Ψ–≤–Β–Κ–Α. βÄî –ö.: –≠–Κ―¹–Ω–Β―Ä―² –¦–Δ–î, 2008. βÄî 552 ―¹.
–ö–Μ―é―΅–Ψ–≤―• ―¹–Μ–Ψ–≤–Α: –¥―•―²–Η ―Ä–Α–Ϋ–Ϋ―¨–Ψ–≥–Ψ –≤―•–Κ―É, –≥–Α―¹―²―Ä–Ψ–Β–Ϋ―²–Β―Ä–Ψ–Μ–Ψ–≥―•―΅–Ϋ―• –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ–Ϋ―è, –Φ―•–Κ―Ä–Ψ–±―•–Ψ―Ü–Β–Ϋ–Ψ–Ζ, ―•–Φ―É–Ϋ―•―²–Β―², –Κ–Ψ―Ä–Β–Κ―Ü―•―è, ¬Ϊ–€―É–Μ―¨―²–Η–Ω―Ä–Ψ–±―•–Ψ―²–Η–Κ –ê–Ω―•–±–Α–Κ―²¬Μ.
–ö–Μ―é―΅–Β–≤―΄–Β ―¹–Μ–Ψ–≤–Α: –¥–Β―²–Η ―Ä–Α–Ϋ–Ϋ–Β–≥–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α, –≥–Α―¹―²―Ä–Ψ―ç–Ϋ―²–Β―Ä–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ―Ü–Β–Ϋ–Ψ–Ζ, –Η–Φ–Φ―É–Ϋ–Η―²–Β―², –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η―è, ¬Ϊ–€―É–Μ―¨―²–Η–Ω―Ä–Ψ–±–Η–Ψ―²–Η–Κ –ê–Ω–Η–±–Α–Κ―²¬Μ.
Key words: early infants, gastroenterological diseases, microbiocenosis, immunity status, correction, Apibact multiprobiotic.
–†–Β–Κ–Μ–Α–Φ–Α:
–Κ–Ϋ–Η–≥–Η –Κ―É–Ω–Η―²―¨ –Φ–Β–¥–Η―Ü–Η–Ϋ–Α, –Α–Ϋ–≥–Μ–Η–Ι―¹–Κ–Η–Ι
–Α–Ϋ–≥–Μ–Η–Ι―¹–Κ–Η–Ι ―è–Ζ―΄–Κ –û–Κ―¹―³–Ψ―Ä–¥ ―É―΅–Β–±–Ϋ–Η–Κ–Η –¥–Μ―è –¥–Β―²–Β–Ι –Η –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö
–ê.–ê.–Δ–Η–Φ–Ψ―³–Β–Β–≤ ―¹―²–Ψ–Φ–Α―²–Ψ–Μ–Ψ–≥–Η―è –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Η–Β –Κ–Ϋ–Η–≥–Η
–ß–Η―²–Α–Ι―²–Β ―²–Α–Κ–Ε–Β –Ϋ–Ψ–≤–Ψ―¹―²–Η –Ζ–¥–Ψ―Ä–Ψ–≤―¨–Β –≤ –≥–Μ–Α–≤–Ϋ―΄―Ö –Ϋ–Ψ–≤–Ψ―¹―²―è―Ö –Θ–Κ―Ä–Α–Η–Ϋ―΄, –†–Ψ―¹―¹–Η–Η, –ï–≤―Ä–Ψ–Ω―΄ –Η –Φ–Η―Ä–Α
–ö –≤–Α―à–Η–Φ ―É―¹–Μ―É–≥–Α–Φ ―¹―²–Ψ–Φ–Α―²–Ψ–Μ–Ψ–≥–Η―è –Η –Ζ―É–±–Ϋ–Ψ–Β –Ω―Ä–Ψ―²–Β–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β
–•–Β–Ϋ―¹–Κ–Η–Β –Ϋ–Ψ–≤–Ψ―¹―²–Η. –ö―Ä–Α―¹–Ψ―²–Α –Η –Ζ–¥–Ψ―Ä–Ψ–≤―¨–Β |
 |
Χεδίξώοεπρ. Χεδηωημώξηε ώρύρϋη. Χεδηωημύ, κεςεμηε,
γδνπνβϋε
|

| Έοσακηξνβύμν:
2009/8/12 12:05:20
12704 |
|
 |